Số khối là gì? Mass Number trong phân rã phóng xạ
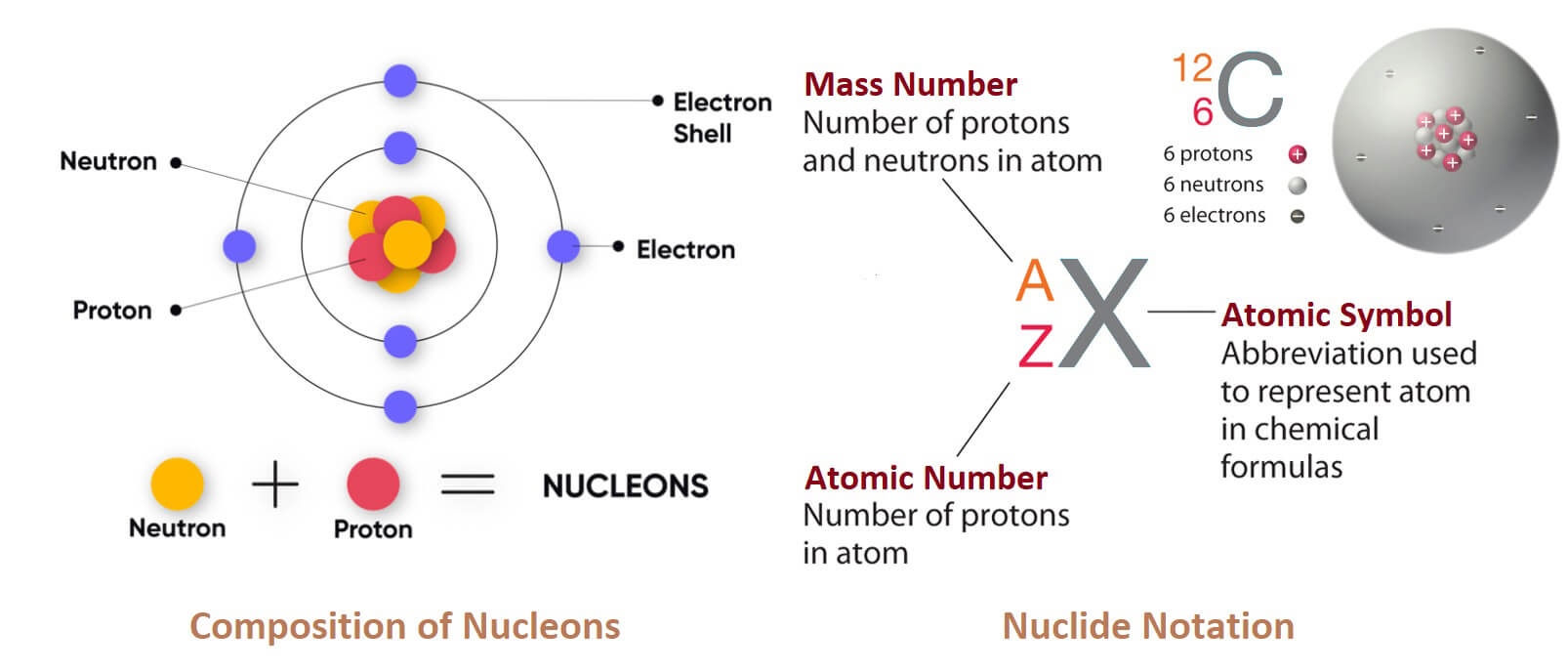
Số khối là gì?
Số khối hay mass number (ký hiệu A, từ tiếng Đức Atomgewicht – “khối lượng nguyên tử”), còn gọi là số khối nguyên tử hoặc số nucleon, là tổng số proton và neutron (gọi chung là nucleon) trong hạt nhân nguyên tử. Số khối xấp xỉ bằng khối lượng nguyên tử (hay khối lượng đồng vị) của nguyên tử tính theo đơn vị dalton.
Vì proton và neutron đều là baryon, nên số khối A cũng chính là số baryon B của hạt nhân (và của toàn bộ nguyên tử hoặc ion).
Số khối khác nhau đối với mỗi đồng vị của một nguyên tố hóa học nhất định, và hiệu giữa số khối và số nguyên tử Z cho ta số neutron N trong hạt nhân:
- N=A−Z
Số khối được viết sau tên nguyên tố hoặc dưới dạng chỉ số trên đặt bên trái ký hiệu nguyên tố. Ví dụ:
Đồng vị phổ biến nhất của carbon là carbon-12 hay ¹²C, gồm 6 proton và 6 neutron.
Ký hiệu đầy đủ sẽ bao gồm cả số nguyên tử Z dưới dạng chỉ số dưới bên trái ký hiệu nguyên tố, nằm ngay dưới số khối.
Sự thay đổi số khối trong phân rã phóng xạ
Các loại phân rã phóng xạ khác nhau được đặc trưng bởi sự thay đổi số khối và số nguyên tử, theo định luật dịch chuyển phóng xạ của Fajans và Soddy.
Ví dụ, uranium-238 thường phân rã bằng phân rã alpha, trong đó hạt nhân mất hai neutron và hai proton dưới dạng một hạt alpha. Do đó:
- Số nguyên tử (Z) giảm 2: 92 → 90
- Số neutron (N) giảm 2: 146 → 144
- Số khối (A) giảm 4: 238 → 234
- Kết quả là hình thành nguyên tử thorium-234.
Phân rã beta của carbon-14
Ngược lại, carbon-14 phân rã bằng phân rã beta (β⁻), trong đó một neutron biến đổi thành một proton, đồng thời phát ra một electron và một phản neutrino.
Do đó:
- Số nguyên tử (Z) tăng 1: 6 → 7
- Số khối (A) giữ nguyên: 14
- Số neutron (N) giảm 1: 8 → 7
- Kết quả là hình thành nguyên tử nitơ-14.
Phân rã beta và phân rã gamma
Phân rã beta có thể xảy ra vì các đồng khối khác nhau có sự chênh lệch khối lượng cỡ vài electron. Nếu có thể, một hạt nhân sẽ phân rã beta thành đồng khối kề với khối lượng nhỏ hơn. Trong trường hợp không có các chế độ phân rã khác, một chuỗi phân rã beta sẽ kết thúc tại đồng khối có khối lượng nguyên tử nhỏ nhất.
Một loại phân rã phóng xạ khác mà không làm thay đổi số khối là phát xạ tia gamma từ một đồng phân hạt nhân hoặc trạng thái kích thích chuyển tiếp của hạt nhân nguyên tử. Vì tất cả các proton và neutron vẫn giữ nguyên trong hạt nhân, nên số khối A cũng không thay đổi.
Số khối và khối lượng đồng vị
Số khối cung cấp một ước lượng về khối lượng đồng vị được đo bằng dalton (Da).
Đối với ¹²C, khối lượng đồng vị chính xác là 12, vì dalton được định nghĩa là 1/12 khối lượng của ¹²C.
Đối với các đồng vị khác, khối lượng đồng vị thường nằm trong khoảng ±0,1 Da so với số khối.
Ví dụ: ³⁵Cl (17 proton và 18 neutron) có số khối = 35 và khối lượng đồng vị = 34,96885.
Hiệu số giữa khối lượng đồng vị thực tế và số khối của nguyên tử được gọi là thặng dư khối lượng (mass excess), đối với ³⁵Cl là –0,03115.
- Lưu ý: thặng dư khối lượng không nên nhầm với thiếu hụt khối lượng, là hiệu số giữa khối lượng của nguyên tử và tổng khối lượng các hạt cấu thành (proton, neutron và electron).
Hai nguyên nhân chính gây ra thặng dư khối lượng
Neutron nặng hơn proton một chút
Điều này làm tăng khối lượng của các hạt nhân có nhiều neutron hơn proton, so với dalton dựa trên ¹²C (có số proton và neutron bằng nhau).
Năng lượng liên kết hạt nhân khác nhau giữa các hạt nhân
Một hạt nhân có năng lượng liên kết lớn hơn sẽ có năng lượng tổng thấp hơn, do đó khối lượng thấp hơn theo phương trình tương đương khối lượng – năng lượng của Einstein:
- E=mc^2
Đối với ³⁵Cl, khối lượng đồng vị nhỏ hơn 35, nên yếu tố này phải là yếu tố chi phối.
Khối lượng nguyên tử tương đối của một nguyên tố
Số khối không nên nhầm lẫn với khối lượng nguyên tử chuẩn (còn gọi là atomic weight) của một nguyên tố, là tỉ số giữa khối lượng nguyên tử trung bình của các đồng vị khác nhau của nguyên tố đó (có tính đến tỉ lệ xuất hiện) và hằng số khối lượng nguyên tử.
Khối lượng nguyên tử chuẩn là một tỉ số khối lượng, trong khi số khối là một con số đếm (vì vậy là một số nguyên).
Điểm quan trọng về khối lượng nguyên tử tương đối
Khối lượng trung bình có thể khác với số nguyên gần đúng của các đồng vị riêng lẻ
- Ví dụ: Clo có hai đồng vị chính: ³⁵Cl và ³⁷Cl.
- Trong bất kỳ mẫu clo nào chưa tách đồng vị, sẽ có khoảng 75% nguyên tử là ³⁵Cl và 25% là ³⁷Cl.
- Điều này cho khối lượng nguyên tử tương đối của clo là 35,5 (thực ra là 35,4527 g/mol).
Khối lượng trung bình có thể gần số nguyên, nhưng không tương ứng với khối lượng của bất kỳ đồng vị tự nhiên nào
- Ví dụ: Brom có hai đồng vị ổn định: ⁷⁹Br và ⁸¹Br, xuất hiện với tỉ lệ xấp xỉ bằng nhau.
- Do đó, khối lượng nguyên tử chuẩn của brom gần bằng 80 (79,904 g/mol), dù ⁸⁰Br là đồng vị không ổn định.