Potassium là gì? Kali trong công nghiệp và thương mại
Kali là gì?
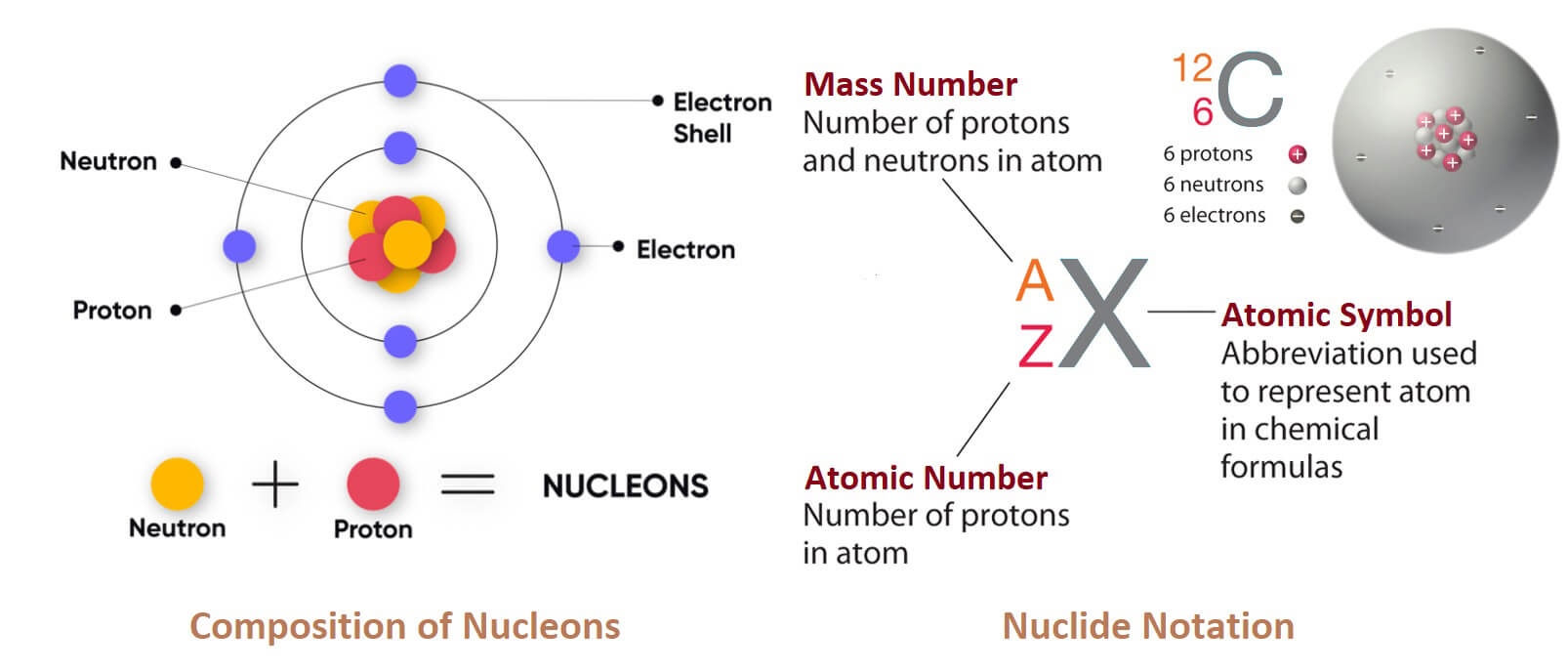
Potassium (Kali) là một nguyên tố hóa học; nó có ký hiệu K (từ tiếng Latin mới kalium) và số nguyên tử là 19. Nó là một kim loại màu trắng bạc, mềm đến mức có thể dễ dàng cắt bằng dao. Kim loại kali phản ứng nhanh với oxy trong khí quyển để tạo thành kali peroxit màu trắng dạng vảy chỉ sau vài giây tiếp xúc. Nó lần đầu tiên được phân lập từ kali, tro của cây, và từ đó tên gọi của nó bắt nguồn.
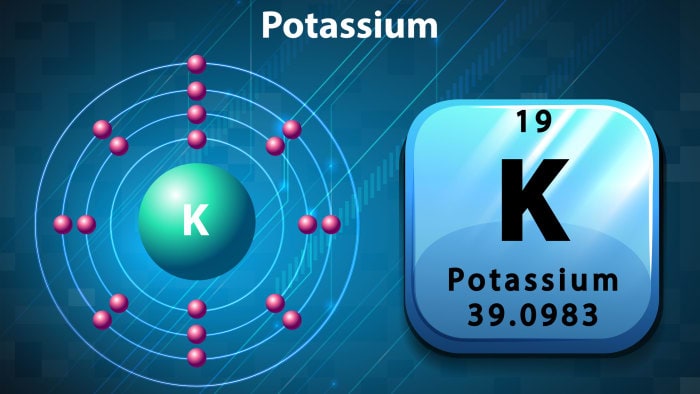
Trong bảng tuần hoàn, kali là một trong những kim loại kiềm, tất cả đều có một electron hóa trị đơn ở lớp electron ngoài cùng, dễ dàng bị loại bỏ để tạo thành ion mang điện tích dương (kết hợp với anion tạo thành muối).
Trong tự nhiên, kali chỉ tồn tại dưới dạng muối ion. Kali nguyên tố phản ứng mạnh với nước, tạo ra đủ nhiệt để đốt cháy hydro được giải phóng trong phản ứng và cháy với ngọn lửa màu tím hoa cà. Nó được tìm thấy hòa tan trong nước biển (chứa 0,04% kali theo trọng lượng) và có trong nhiều khoáng chất như orthoclase, một thành phần phổ biến của đá granit và các loại đá macma khác.
| Thuộc tính | Giá trị |
| Số hiệu nguyên tử | 19 |
| Nhóm | nhóm 1: hydro và kim loại kiềm |
| Chu kì | chu kì 4 |
| Khối | s-block |
| Cấu hình electron | [Ar] 4s¹ |
| Số electron mỗi lớp | 2, 8, 8, 1 |
| Trạng thái ở STP | rắn |
| Nhiệt độ nóng chảy | 336.7 K (63.5 °C) |
| Nhiệt độ sôi | 1030.79 K (757.643 °C) |
| Khối lượng riêng (20°C) | 0.8590 g/cm³ |
| Khối lượng riêng (khi nóng chảy) | 0.82948 g/cm³ |
| Điểm tới hạn | 2223 K, 16 MPa |
| Nhiệt nóng chảy | 2.33 kJ/mol |
| Nhiệt hóa hơi | 76.9 kJ/mol |
| Nhiệt dung mol | 29.6 J/(mol·K) |
| Trạng thái oxi hóa | 1 |
| Độ âm điện | 0.82 (thang Pauling) |
| Năng lượng ion hóa đầu | 418.8 kJ/mol |
| Bán kính nguyên tử | 227 pm |
| Bán kính cộng hóa trị | 203 ± 12 pm |
| Bán kính Van der Waals | 275 pm |
| Sự xuất hiện tự nhiên | nguyên thủy |
| Cấu trúc tinh thể | lập phương tâm khối (bcc) |
| Hệ số giãn nở nhiệt | 77.37 × 10⁻⁶/K |
| Độ dẫn nhiệt | 102.5 W/(m·K) |
| Điện trở suất | 72 nΩ·m |
| Trật tự từ | thuận từ (paramagnetic) |
| Mô đun Young | 3.53 GPa |
| Mô đun trượt | 1.3 GPa |
| Mô đun nén | 3.1 GPa |
| Tốc độ truyền âm | 2000 m/s |
| Độ cứng Mohs | 0.4 |
| Độ cứng Brinell | 0.363 MPa |
| CAS Number | 7440-09-07 |
| Đồng vị chính | ³⁹K (93.3%), ⁴⁰K (0.0117%), ⁴¹K (6.73%) |
Tính chất của Potassium
Tính chất vật lý của Kali
Kali là kim loại có mật độ thấp thứ hai, chỉ sau liti. Nó là một chất rắn mềm, có điểm nóng chảy thấp và có thể dễ dàng cắt bằng dao. Kali có màu bạc, nhưng bắt đầu xỉn sang màu xám gần như ngay lập tức khi tiếp xúc với không khí.
Trong phép thử ngọn lửa, kali và các hợp chất của nó phát ra màu tím nhạt với bước sóng phát xạ cực đại là 766,5 nanomet.
Tính chất hóa học của Kali
Kali phản ứng với oxy, nước và carbon dioxide trong không khí. Với oxy, nó tạo thành kali peroxit. Khi tiếp xúc với nước, kali tạo ra kali hydroxit (KOH).
Phản ứng của kali với nước có thể tỏa nhiệt mạnh và nguy hiểm, đặc biệt vì khí hydro sinh ra có thể bốc cháy. Vì lý do này, kali và hợp kim natri–kali (NaK) từng được dùng làm chất hút ẩm mạnh, mặc dù ngày nay chúng không còn được sử dụng cho mục đích đó.
Hợp chất của Kali
Bốn oxit của kali được nghiên cứu kỹ bao gồm: kali oxit (K₂O), kali peroxit (K₂O₂), kali superoxit (KO₂) và kali ozonide (KO₃). Các hợp chất nhị phân giữa kali và oxy phản ứng với nước tạo thành KOH.
KOH là một bazơ mạnh. Thể hiện tính ưa nước cao, tới 1,21 kg KOH có thể hòa tan trong 1 lít nước. Dạng KOH khan rất hiếm gặp.
KOH phản ứng dễ dàng với khí carbon dioxide (CO₂) tạo ra kali carbonat (K₂CO₃) và về lý thuyết có thể được dùng để loại bỏ lượng CO₂ nhỏ trong không khí. Tương tự như natri hydroxit, KOH phản ứng với chất béo để tạo ra xà phòng.
Đồng vị
Có 25 đồng vị của kali đã được biết đến, trong đó ba đồng vị tồn tại tự nhiên: ³⁹K (93,3%), ⁴⁰K (0,0117%) và ⁴¹K (6,7%). Đồng vị tự nhiên ⁴⁰K có chu kỳ bán rã là 1,250 × 10⁹ năm.
Nó phân rã thành ⁴⁰Ar bền thông qua bắt electron hoặc phát positron (11,2%), hoặc phân rã beta tạo thành ⁴⁰Ca bền (88,8%).
Quá trình phân rã của ⁴⁰K thành ⁴⁰Ar là cơ sở của một phương pháp phổ biến dùng để xác định tuổi của đá.
Sự xuất hiện
Kali được hình thành trong các vụ nổ siêu tân tinh thông qua quá trình tổng hợp hạt nhân từ các nguyên tử nhẹ hơn. Kali chủ yếu được tạo ra trong các siêu tân tinh loại II thông qua quá trình đốt cháy oxy nổ.
Đây là các phản ứng nhiệt hạch (nuclear fusion), không nên nhầm lẫn với sự cháy hóa học của kali trong oxy. Đồng vị ⁴⁰K cũng được tạo thành trong quá trình tổng hợp s-process và quá trình đốt cháy neon.
Kali là nguyên tố đứng thứ 20 về độ phong phú trong Hệ Mặt Trời và đứng thứ 17 theo khối lượng trên Trái Đất. Nó chiếm khoảng 2,6% khối lượng vỏ Trái Đất và là nguyên tố phong phú thứ bảy trong vỏ.
Nồng độ kali trong nước biển là 0,39 g/L (0,039% khối lượng/thể tích), xấp xỉ bằng một phần hai mươi bảy so với nồng độ natri.
Địa chất
Kali nguyên tố không tồn tại trong tự nhiên do tính phản ứng rất cao của nó. Kali phản ứng mãnh liệt với nước và cũng phản ứng với oxy. Orthoclase (felspat kali) là một khoáng vật phổ biến tạo đá.
Ví dụ, đá granite chứa khoảng 5% kali, cao hơn mức trung bình trong vỏ Trái Đất. Sylvite (KCl), carnallite (KCl·MgCl₂·6H₂O), kainite (MgSO₄·KCl·3H₂O) và langbeinite (MgSO₄·K₂SO₄) là những khoáng vật được tìm thấy trong các mỏ trầm tích bay hơi (evaporite) lớn trên toàn thế giới.
Sản xuất thương mại
Khai thác Kali
Các muối kali như carnallite, langbeinite, polyhalite và sylvite tạo thành các mỏ evaporite rộng lớn ở đáy hồ và đáy biển cổ đại, giúp việc khai thác muối kali trong các môi trường này trở nên khả thi về mặt thương mại. Nguồn kali chính – kali – được khai thác ở Canada, Nga, Belarus, Kazakhstan, Đức, Israel, Hoa Kỳ, Jordan và các nơi khác trên thế giới.
Chiết xuất hóa học Kali
Có một số phương pháp được sử dụng để tách muối kali khỏi các hợp chất natri và magie.
Phương pháp được sử dụng nhiều nhất là kết tủa phân đoạn dựa trên sự khác biệt về độ hòa tan của các muối.
Phân tách tĩnh điện hỗn hợp muối ngầm cũng được sử dụng trong một số mỏ.
Chất thải natri và magie thu được được lưu trữ dưới lòng đất hoặc được chất đống trong các đống xỉ. Phần lớn khoáng chất kali khai thác được sau khi xử lý sẽ trở thành kali clorua. Ngành công nghiệp khoáng sản gọi kali clorua là kali, muriate kali, hoặc đơn giản là MOP.
Xác định cation
Kali hiện được định lượng bằng các kỹ thuật ion hóa, nhưng trước đây nó được định lượng bằng phân tích trọng lượng.
Các thuốc thử được sử dụng để kết tủa muối kali bao gồm natri tetraphenylborat, axit hexachloroplatinic và natri cobaltinitrit thành kali tetraphenylborat, kali hexachloroplatinat và kali cobaltinitrit.
Ứng dụng thương mại của Potassium (Kali)
Ứng dụng y học của kali
Potassium citrate
Potassium citrate được dùng để điều trị một tình trạng sỏi thận gọi là nhiễm toan ống thận (renal tubular acidosis).
Potassium chloride
Kali ở dạng kali clorua được sử dụng như một loại thuốc để điều trị và ngăn ngừa tình trạng hạ kali máu (thiếu kali trong máu). Hạ kali máu có thể xảy ra do nôn mửa, tiêu chảy hoặc do tác dụng của một số loại thuốc. Kali clorua có thể được dùng bằng đường uống hoặc tiêm tĩnh mạch chậm.
Phụ gia thực phẩm
Potassium sodium tartrate (KNaC₄H₄O₆, muối Rochelle) là thành phần chính trong một số loại bột nở; nó cũng được sử dụng trong quá trình tráng bạc gương.
Potassium bromate (KBrO₃) là một chất oxy hóa mạnh (E924), được dùng để tăng độ dai và độ nở của bột mì.
Ứng dụng kali trong ông nghiệp
Các hóa chất kali quan trọng nhất bao gồm kali hydroxit, kali carbonat, kali sunfat và kali clorua. Mỗi năm có hàng triệu tấn các hợp chất này được sản xuất.
Ứng dụng chuyên biệt
Có hàng nghìn ứng dụng khác nhau của các hợp chất kali.
Một ví dụ là kali superoxide, KO₂, một chất rắn màu cam hoạt động như nguồn cung cấp oxy di động đồng thời hấp thụ carbon dioxide.
Nó được sử dụng rộng rãi trong các hệ thống hô hấp của mỏ, tàu ngầm và tàu vũ trụ vì nó chiếm ít thể tích hơn so với oxy dạng khí.
Ứng dụng trong phòng thí nghiệm
Hợp kim natri–kali, NaK, là chất lỏng được dùng làm chất truyền nhiệt và chất hút ẩm nhằm tạo ra dung môi khô và không có không khí.
Nó cũng có thể được sử dụng trong chưng cất phản ứng. Hợp kim ba thành phần gồm 12% Na, 47% K và 41% Cs có điểm nóng chảy thấp nhất so với bất kỳ hợp chất kim loại nào: –78 °C.
Kali kim loại được dùng trong một số loại máy đo từ kế (magnetometers).
Vai trò sinh học của Potassium (Kali)
Kali là nguyên tố phổ biến đứng thứ tám hoặc thứ chín (0,2% theo khối lượng) trong cơ thể người. Một người trưởng thành nặng 60 kg chứa khoảng 120 g kali.
Cơ thể chứa lượng kali tương đương với lưu huỳnh và clo; chỉ có canxi và phốt pho là nhiều hơn (không tính nhóm nguyên tố phổ biến CHON). Ion kali hiện diện trong nhiều loại protein và enzyme khác nhau. Kali chủ yếu tồn tại trong tế bào (nội bào).
Chức năng sinh hóa của kali
Kali tham gia vào nhiều quá trình sinh lý quan trọng, bao gồm:
- Tiết hormone và tác động của hormone
- Điều hòa trương lực mạch máu
- Kiểm soát huyết áp hệ thống
- Điều hòa nhu động tiêu hóa
- Cân bằng acid–base
- Chuyển hóa glucose và insulin
- Tác động của hormone mineralocorticoid
- Khả năng cô đặc nước tiểu của thận
- Cân bằng chất lỏng và điện giải
- Điều hòa nồng độ norepinephrine, serotonin và dopamine ở vỏ não, từ đó ảnh hưởng đến trạng thái ngủ/thức và hoạt động tự phát