Gallium là gì? Ứng dụng của Gali trong sản xuất & y học
Gallium là gì?
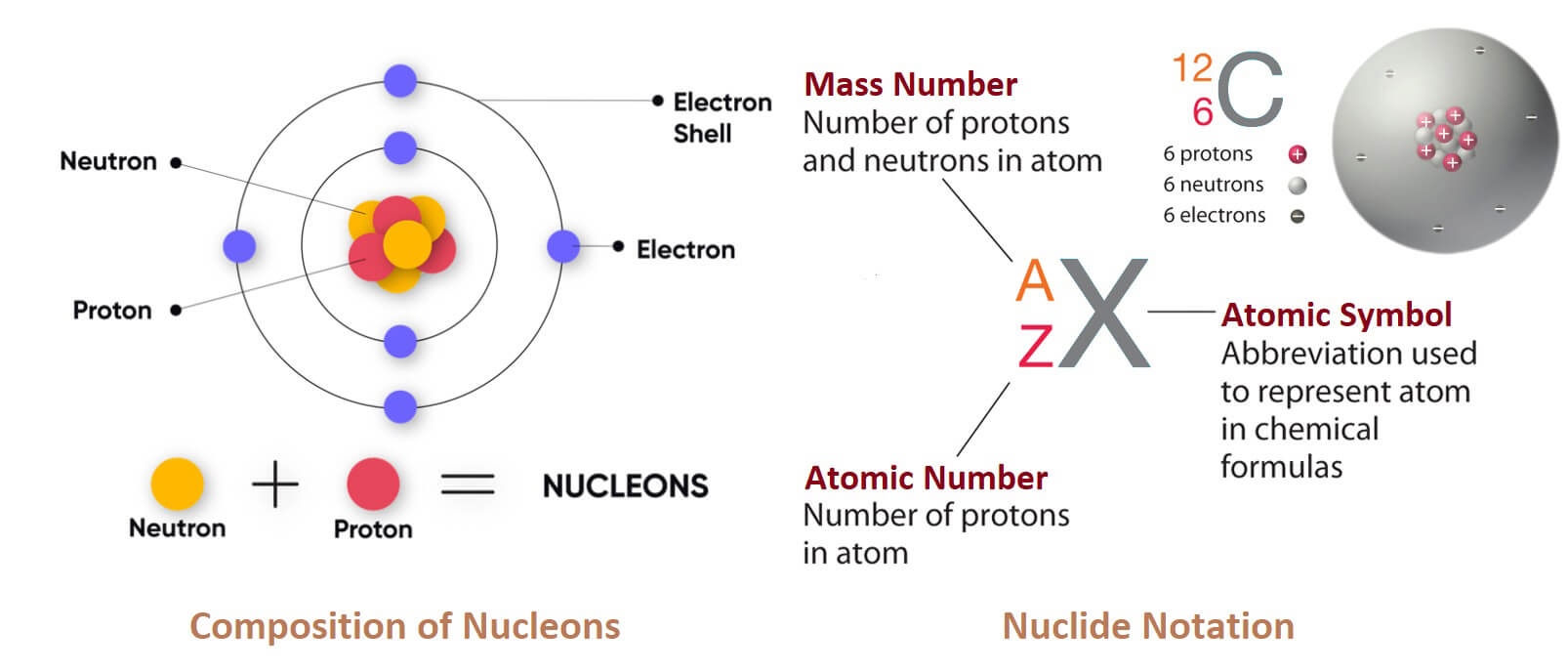
Gallium (Gali) là một nguyên tố hóa học; nó có ký hiệu Ga và số nguyên tử 31. Được phát hiện bởi nhà hóa học người Pháp Paul-Émile Lecoq de Boisbaudran vào năm 1875, gallium nguyên chất là một kim loại mềm, màu bạc ở nhiệt độ và áp suất chuẩn. Trong trạng thái lỏng, nó có màu trắng bạc. Nếu tác dụng đủ lực, gallium rắn có thể bị gãy theo dạng vết nứt hình vỏ sò.
Kể từ khi được phát hiện năm 1875, gallium đã được sử dụng rộng rãi để tạo hợp kim có điểm nóng chảy thấp. Nó cũng được dùng trong chất bán dẫn, như một chất pha tạp trong nền bán dẫn.
Điểm nóng chảy của gallium là 29,7646 °C (85,5763 °F; 302,9146 K), được dùng làm điểm tham chiếu nhiệt độ. Hợp kim gallium được dùng trong nhiệt kế như một lựa chọn thay thế không độc hại và thân thiện với môi trường so với thủy ngân, và có thể chịu được nhiệt độ cao hơn thủy ngân.
Một điểm nóng chảy là −19 °C (−2 °F), thấp hơn điểm đóng băng của nước, được ghi nhận cho hợp kim galinstan (62–95% gallium, 5–22% indium, và 0–16% thiếc theo trọng lượng), nhưng điều này có thể là điểm đông với hiệu ứng siêu làm lạnh.
Bảng thông tin nguyên tố Gallium (Ga)
Tính chất vật lý
| Trạng thái vật chất | Chất rắn |
| Nhiệt độ nóng chảy | 302,9146 K (29,7646 °C, 85,5763 °F) |
| Nhiệt độ sôi | 2676 K (2403 °C, 4357 °F) |
| Mật độ | 5,907 g/cm 3 (ở 20 °C) |
| Mật độ ở thể lỏng |
Ở nhiệt độ nóng chảy: 6,095 g/ cm3 |
| Nhiệt lượng nóng chảy | 5,59 kJ/mol |
| Nhiệt bay hơi | 256 kJ/mol |
| Nhiệt dung | 25,86 J/(mol·K) |
Áp suất hơi
| P (Pa) | 1 | 10 | 100 | 1k | 10k | 100k |
| ở T (K) | 1310 | 1448 | 1620 | 1838 | 2125 | 2518 |
Thông tin khác
| Nguồn gốc tự nhiên | Nguyên thủy |
| Cấu trúc tinh thể | Lưới tinh thể trực thoi tâm đáy (oS8) |
| Hằng số mạng | a = 452,05 pm b = 766,25 pm c = 452,66 pm (ở 20 °C) |
| Độ giãn nở nhiệt | 20,5 × 10 −6 /K (ở 20 °C) |
| Độ dẫn nhiệt | 40,6 W/(m⋅K) |
| Điện trở suất | 270 nΩ⋅m (ở 20 °C) |
| Tính chất từ | Nghịch từ |
| Độ cảm từ | −21,6 × 10 −6 cm 3 /mol (ở 290 K) |
| Mô đun Young | 9,8 GPa |
| Tốc độ âm thanh | 2740 m/s (ở nhiệt độ phòng ) |
| Hệ số Poisson | 0,47 |
| Độ cứng theo thang Mohs | 1,5 |
| Độ cứng theo thang Brinell | 56,8–68,7 MPa |
| Số đăng ký CAS | 7440-55-3 |
Lịch sử
| Đặt tên | theo Gallia (tiếng Latin có nghĩa là: Pháp), quê hương của người khám phá |
| Dự đoán | Dmitri Mendeleev (1871) |
| Khám phá và phân lập đầu tiên | Lecoq de Boisbaudran (1875) |
Đồng vị của Gallium
| Iso | NA | Chu kỳ bán rã | DM | DP |
| 66 Ga | Tổng hợp | 9,304 giờ | β+ | 66Zn |
| 67 Ga | Tổng hợp | 3,2617 ngày | ϵ | 67Zn |
| 68 Ga | Tổng hợp | 67,84 phút | β+ | 68Zn |
| 69 Ga | 60,1% | Ổn định | ||
|
70 Ga
|
Tổng hợp
|
21,14 phút
|
β− | 70Ge |
| ϵ | 70Zn | |||
| 71 Ga | 39,9% | Ổn định | ||
| 72 Ga | Tổng hợp | 14,025 giờ | β− | 72Ge |
| 73 Ga | Tổng hợp | 4,86 giờ | β− | 73Ge |
Tính chất vật lý
Gallium nguyên chất không tồn tại trong tự nhiên, nhưng có thể dễ dàng thu được bằng cách luyện kim. Gallium tinh khiết có màu bạc xanh và gãy theo dạng vết nứt hình vỏ sò giống như thủy tinh.
Thể tích của gallium tăng 3,10% khi chuyển từ trạng thái lỏng sang rắn, vì vậy cần cẩn thận khi bảo quản nó trong các bình chứa có thể bị vỡ khi vật chất thay đổi trạng thái. Gallium là một trong số ít các chất có trạng thái lỏng có mật độ cao hơn so với trạng thái rắn, cùng với một danh sách ngắn các vật liệu khác bao gồm nước, silic, germanium, bismuth và plutoni.
Gallium có thể tạo hợp kim với hầu hết các kim loại. Nó dễ dàng khuếch tán vào các vết nứt hoặc ranh giới tinh thể của một số kim loại như nhôm, hợp kim nhôm–kẽm và thép, gây mất cực độ về độ bền và độ dẻo dai, hiện tượng này được gọi là “làm giòn kim loại lỏng”.
| Tài sản | a | b | c |
| α (~25 °C, μm/m) | 16 | 11 | 31 |
| ρ (29,7 °C, nΩ·m) | 543 | 174 | 81 |
| ρ (0 °C, nΩ·m) | 480 | 154 | 71,6 |
| ρ (77 K, nΩ·m) | 101 | 30,8 | 14.3 |
| ρ (4,2 K, pΩ·m) | 13,8 | 6.8 | 1.6 |
Đồng vị
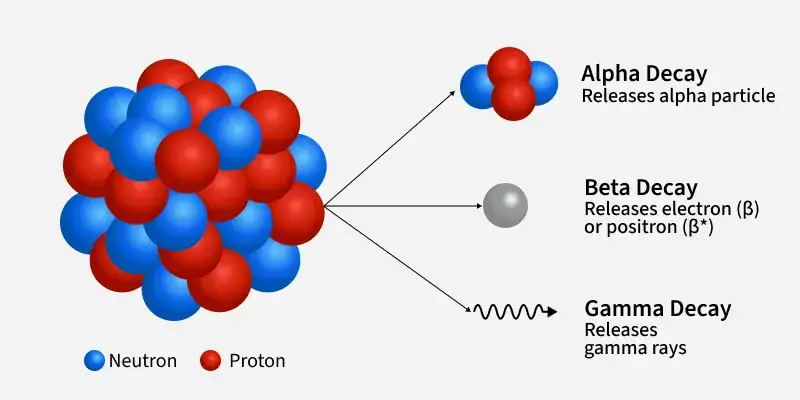
Gali có 30 đồng vị đã biết, với số khối từ 60 đến 89. Chỉ có hai đồng vị bền và tồn tại tự nhiên là gali-69 và gali-71. Gali-69 phổ biến hơn, chiếm khoảng 60,1% gali tự nhiên, trong khi gali-71 chiếm 39,9%.
Tất cả các đồng vị còn lại đều là đồng vị phóng xạ, trong đó gali-67 có chu kỳ bán rã dài nhất (3,2617 ngày).
Các đồng vị nhẹ hơn gali-69 thường phân rã bằng beta dương (phát positron) hoặc bắt electron để tạo thành các đồng vị của kẽm.
Các đồng vị nặng hơn gali-71 phân rã bằng beta âm (phát electron), có thể kèm phát neutron trễ, để tạo thành các đồng vị của germani. Gali-70 có thể phân rã theo cả hai cách, tạo ra kẽm-70 hoặc germani-70.
Gali-67 và gali-68 (chu kỳ bán rã 67,84 phút) đều được sử dụng cho mục đích chẩn đoán trong y học hạt nhân.
Tính chất hóa học
Hóa học trong dung dịch
Axit mạnh hòa tan gali, tạo thành các muối gali(III) như gali nitrat Ga(NO₃)₃. Trong dung dịch, các muối này tồn tại dưới dạng ion gali ngậm nước [Ga(H₂O)₆]³⁺.
Gali(III) hydroxit Ga(OH)₃ có thể được kết tủa từ dung dịch bằng cách thêm amoniac. Khi khử nước Ga(OH)₃ ở 100 °C sẽ thu được gallium oxide hydroxide GaO(OH).
Oxit và chalcogenide
Gali chỉ phản ứng với các nguyên tố thuộc nhóm chalcogen ở nhiệt độ tương đối cao.
Ở nhiệt độ phòng, gali kim loại không phản ứng với không khí và nước vì nó tạo ra một lớp oxit thụ động bảo vệ.
Ở nhiệt độ cao hơn, gali phản ứng với oxy trong không khí để tạo thành gali(III) oxit Ga₂O₃.
Khử Ga₂O₃ bằng gali kim loại trong chân không ở 500–700 °C tạo ra gali(I) oxit Ga₂O có màu nâu đậm.
Ga₂O là chất khử rất mạnh, có thể khử H₂SO₄ thành H₂S. Ở 800 °C, nó bị tự phân hủy trở lại thành gali và Ga₂O₃.
Nitride và pnictide
Gali phản ứng với amoniac ở 1050 °C tạo thành gali nitride GaN.
Gali cũng tạo ra các hợp chất nhị phân với phosphor, asen và antimon: gali phosphide (GaP), gali arsenide (GaAs) và gali antimonide (GaSb).
Các hợp chất này có cấu trúc giống ZnS và có tính chất bán dẫn quan trọng. Chúng có thể được tổng hợp bằng phản ứng trực tiếp giữa gali và phosphor, asen hoặc antimon.
Halide
Gali(III) oxit phản ứng với các chất fluor hóa như HF hoặc F₂ tạo thành gali(III) fluoride GaF₃.
GaF₃ là hợp chất ion rất khó tan trong nước, nhưng hòa tan trong axit HF tạo ra phức GaF₃·3H₂O.
Khi cố gắng khử nước phức này sẽ tạo ra GaF₂OH·nH₂O. Phức này phản ứng với amoniac để tạo GaF₃·3NH₃, có thể được nung nóng để thu được GaF₃ khan.
Hydride
Giống như nhôm, gali cũng tạo thành hydride, GaH3, được gọi là galane, có thể được sản xuất bằng cách phản ứng lithium gallium hydride ( (LiGaH4) với gallium(III) clorua ở −30 °C
Hợp chất organogallium
Các hợp chất organogallium có khả năng phản ứng tương tự như các hợp chất organoindium, ít phản ứng hơn các hợp chất organoaluminium, nhưng phản ứng mạnh hơn các hợp chất organothalium.262–5 Alkylgalli là monome.
Độ axit Lewis giảm dần theo thứ tự Al > Ga > In và do đó các hợp chất organogallium không tạo thành các dimer cầu nối như các hợp chất organoaluminium. Các hợp chất organogallium cũng ít phản ứng hơn các hợp chất organoaluminium. Chúng tạo thành các peroxide ổn định.
Phân bố trong tự nhiên
Gali không tồn tại dưới dạng nguyên tố tự do trong vỏ Trái Đất và các khoáng vật giàu gali như gallite (CuGaS₂) lại quá hiếm để khai thác. Hàm lượng của gali trong vỏ Trái Đất khoảng 16,9 ppm, đứng thứ 34 về độ phổ biến.
Tuy nhiên, khác với các nguyên tố như chì, coban hay niobi, gali không tạo ra các mỏ quặng độc lập với hàm lượng >0,1%. Nó chỉ xuất hiện ở nồng độ vết trong quặng kẽm và ở mức cao hơn (khoảng 50 ppm) trong quặng nhôm. Gali được thu hồi như sản phẩm phụ từ các nguồn này.
Điều này là do đặc tính địa hóa của gali không dẫn đến sự tập trung mạnh trong các quá trình hình thành quặng.
Sản xuất và nguồn cung
Gali được sản xuất hoàn toàn như sản phẩm phụ trong quá trình xử lý quặng của các kim loại khác.
Nguồn chính là bauxite – quặng của nhôm. Một lượng nhỏ cũng được chiết xuất từ quặng kẽm sunfua.
Trong quá khứ, một số loại than từng là nguồn cung cấp gali đáng kể.
Ứng dụng của Gallium
Các ứng dụng bán dẫn chiếm ưu thế trong nhu cầu thương mại về gali, chiếm 98% tổng sản lượng. Ứng dụng chính tiếp theo là garnet gadolinium gallium. Tính đến năm 2022, 44% nhu cầu sử dụng trên thế giới dành cho thiết bị chiếu sáng và 36% cho mạch tích hợp, với tỷ lệ nhỏ hơn, khoảng 7% dành cho quang điện và nam châm.
Chất bán dẫn
Gali có độ tinh khiết cực cao (>99,9999%) được cung cấp trên thị trường để phục vụ ngành công nghiệp bán dẫn.
Gali arsenide (GaAs) và gali nitride (GaN) được sử dụng trong các linh kiện điện tử chiếm khoảng 98% lượng tiêu thụ gali tại Hoa Kỳ vào năm 2007.
Khoảng 66% lượng gali bán dẫn được sử dụng tại Hoa Kỳ trong các mạch tích hợp (chủ yếu là gali arsenide) chẳng hạn như sản xuất chip logic tốc độ cực cao và MESFET cho bộ tiền khuếch đại vi sóng độ ồn thấp trong điện thoại di động. Khoảng 20% lượng gali này được sử dụng trong quang điện tử.
Galinstan và các hợp kim khác
Gali dễ dàng tạo hợp kim với hầu hết các kim loại và được sử dụng làm thành phần trong các hợp kim có nhiệt độ nóng chảy thấp. Hợp kim gần eutectic của gali, indi và thiếc là chất lỏng ở nhiệt độ phòng được sử dụng trong nhiệt kế y tế. Có điểm nóng chảy thấp là −19 °C (−2,2 °F).
Ứng dụng y sinh
Muối radiogallium
Các muối của gali-67 như gali citrate và gali nitrate được dùng làm chất đánh dấu phóng xạ trong kỹ thuật chụp “gali scan”.
Các ứng dụng khác
Phát hiện neutrino: Gali được sử dụng để phát hiện neutrino.
Nguồn ion: Gali cũng được sử dụng làm nguồn ion kim loại lỏng cho chùm ion hội tụ.
Chất bôi trơn: Gali đóng vai trò là chất phụ gia trong sáp trượt cho ván trượt tuyết và các vật liệu bề mặt ma sát thấp khác.
Thiết bị điện tử dẻo: Các nhà khoa học vật liệu suy đoán rằng các đặc tính của Gali có thể khiến nó phù hợp để phát triển các thiết bị dẻo và đeo được.
Sản xuất hydro: Gali phá vỡ lớp oxit bảo vệ trên nhôm, cho phép nước phản ứng với nhôm trong AlGa để tạo ra khí hydro.
Gali trong đại dương
Nhờ tiến bộ trong phân tích vi lượng, các nhà khoa học đã phát hiện dấu vết gali hòa tan trong Đại Tây Dương và Thái Bình Dương.
Trong những năm gần đây, nồng độ gali hòa tan cũng được ghi nhận tại biển Beaufort. Ở Thái Bình Dương, nồng độ gali hòa tan thường khoảng 4–6 pmol/kg ở độ sâu <150 m. Trong khi đó ở Đại Tây Dương, nồng độ khoảng 25–28 pmol/kg ở độ sâu >350 m.