Kẽm là gì? Ứng dụng của Zinc trong công nghiệp
Kẽm là gì?
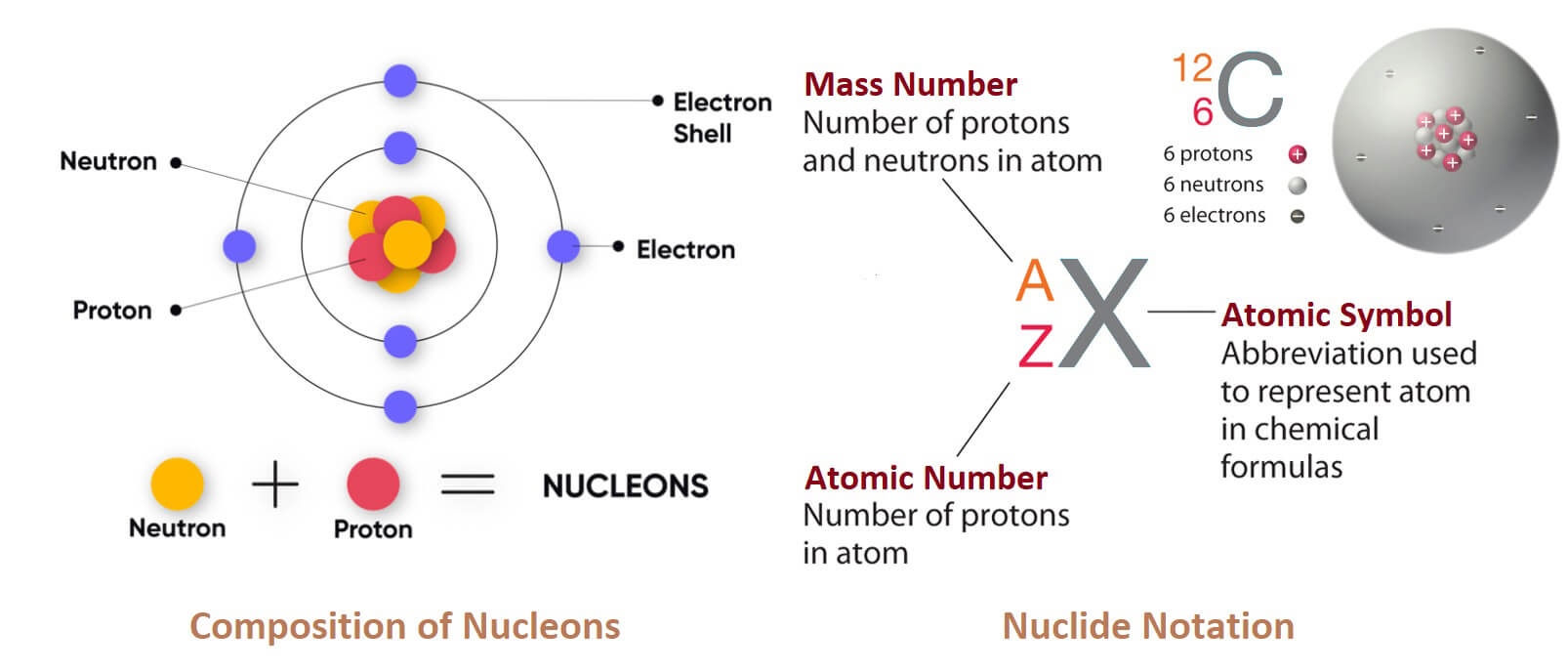
Kẽm (Zinc) là một nguyên tố hóa học, có ký hiệu là Zn và số hiệu nguyên tử là 30. Ở nhiệt độ phòng, kẽm là một kim loại hơi giòn và có màu trắng xanh ánh kim khi lớp oxit trên bề mặt được loại bỏ. Đây là nguyên tố đầu tiên trong nhóm 12 (IIB) của bảng tuần hoàn. Kẽm là nguyên tố phổ biến thứ 24 trong vỏ Trái Đất, với nồng độ trung bình khoảng 70 gam trên mỗi tấn đất. Kẽm có năm đồng vị bền, trong đó Zn-64 là phổ biến nhất, chiếm gần một nửa tổng lượng kẽm.
Ở một số khía cạnh, kẽm có tính chất hóa học tương tự magie: cả hai nguyên tố đều chỉ có một trạng thái oxi hóa thông thường là +2, và ion Zn²⁺ và Mg²⁺ có kích thước tương đương nhau. Quặng kẽm phổ biến nhất là sphalerit (kẽm blende) – một loại khoáng vật sunfua kẽm.

Bảng thông tin nguyên tố Kẽm (Zn)
Tính chất chung
| Tên, ký hiệu | Kẽm, Zn |
| Hình dạng | Ánh kim bạc xám |
| Khối lượng nguyên tử chuẩn (Aᵣ) | 65,38(2) |
Kẽm trong bảng tuần hoàn
| Số nguyên tử (Z) | 30 |
| Nhóm | 12 |
| Chu kỳ | Chu kỳ 4 |
| Khối | d-block |
| Cấu hình electron | [ Ar ] 3d 10 4s 2 |
| Số electron theo lớp | 2, 8, 18, 2 |
Tính chất vật lý
| Trạng thái vật chất | Chất rắn |
| Nhiệt độ nóng chảy | 692,68 K (419,53 °C, 787,15 °F) |
| Nhiệt độ sôi | 1180 K (907 °C, 1665 °F) |
| Mật độ | 7,140g/cm3 (ở 20° C) |
| Mật độ ở thể lỏng | Ở nhiệt độ nóng chảy: 6,57 g/cm³ |
| Nhiệt lượng nóng chảy | 7,32 kJ/mol |
| Nhiệt bay hơi | 115 kJ/mol |
| Nhiệt dung | 25,470 J/(mol K) |
Áp suất hơi
| P (Pa) | 1 | 10 | 100 | 1k | 10k | 100k |
| ở T (K) | 610 | 670 | 750 | 852 | 990 | 1179 |
Tính chất nguyên tử
| Trạng thái oxy hóa | 2,1,0,-2 (lưỡng tính) |
| Độ âm điện | 1,65 (Thang Pauling) |
| Năng lượng ion hóa |
Thứ nhất: 906,4 kJ/mol Thứ hai: 1733,3 kJ/mol Thứ ba: 3833 kJ/mol |
| Bán kính cộng hóa trị | 134 pm (thực nghiệm) |
| Bán kính liên kết cộng hóa trị | 122 ± 4 pm |
| Bán kính van der Waals | 139 pm |
Thông tin khác
| Nguồn gốc tự nhiên | Nguyên thủy |
| Cấu trúc tinh thể | Lục phương |
| Hằng số mạng | a = 266,46 pm c = 494,55 pm (ở 20 °C) |
| Độ giãn nở nhiệt | 30,08 × 10 −6 /K (ở 20 °C) |
| Độ dẫn nhiệt | 116 W/(m⋅K) |
| Điện trở suất | 59,0 nΩ⋅m (ở 20 °C) |
| Tính chất từ | Nghịch từ |
| Độ cảm từ | −11,4 × 10 −6 cm 3 /mol (298 K) |
| Mô đun Young | 108 GPa |
| Mô đun cắt | 43 GPa |
| Mô đun khối | 70 GPa |
| Tốc độ âm thanh | Que mỏng: (cuộn dây) 3850 m/s ( ở nhiệt độ phòng ) |
| Hệ số Poisson | 0,25 |
| Độ cứng theo thang Mohs | 2,5 |
| Độ cứng theo thang Brinell | 327 – 412 MPa |
| Số đăng ký CAS | 7440-66-6 |
Lịch sử
| Đặt tên | Có lẽ từ tiếng Đức zinke, “giống răng”, vì các tinh thể của nó giống như kim |
| Khám phá | Các nhà luyện kim Ấn Độ (trước năm 1000 TCN ) |
| Phân lập đầu tiên | Andreas Sigismund Marggraf (1746) |
| Được công nhận là một kim loại độc đáo bởi | Rasaratna Samuccaya (1300) |
Đồng vị của Kẽm
| Iso | NA | Chu kỳ bán rã | DM | DE | DP |
| ⁶⁴Zn | 48,6% | Ổn định với 34 neutron | |||
| ⁶⁵Zn | Tổng hợp | 243,8 ngày | e | 1.3519 | ⁶⁵Cu |
| Y | 1.1155 | – | |||
| ⁶⁶Zn | 27,9% | Ổn định với 36 neutron | |||
| ⁶⁷Zn | 4,1% | Ổn định với 37 neutron | |||
| ⁶⁸Zn | 18,8% | Ổn định với 38 neutron | |||
| ⁶⁹Zn | Tổng hợp | 56 phút | β⁺ | 0,906 | ⁶⁹Ga |
| ⁶⁹ᵐZn | Tổng hợp | 13,76 giờ | β⁺ | 0,906 | ⁶⁹Ga |
| ⁷⁰Zn | Tổng hợp | Ổn định với 40 neutron | |||
| ⁷¹Zn | Tổng hợp | 2,4 phút | β⁻ | 2,82 | ⁷¹Ga |
| ⁷¹ᵐZn | Tổng hợp | 3,97 ngày | β⁻ | 2,82 | ⁷¹Ga |
| ⁷²Zn | Tổng hợp | 46,5 giờ | β⁻ | 0,458 | ⁷²Ga |
Đặc điểm của Kẽm
Tính chất vật lý
Kẽm là kim loại có màu trắng xanh, sáng bóng và có tính nghịch từ, mặc dù hầu hết các loại kẽm thương mại thông thường đều có bề mặt mờ. Nó có khối lượng riêng nhỏ hơn sắt một chút và có cấu trúc tinh thể lục giác, thuộc dạng biến thể của kiểu xếp chặt lục giác, trong đó mỗi nguyên tử có sáu nguyên tử lân cận gần nhất (ở khoảng cách 265,9 pm) trong cùng mặt phẳng và sáu nguyên tử khác ở khoảng cách xa hơn (290,6 pm).
Kẽm là kim loại cứng và giòn ở hầu hết các nhiệt độ, nhưng trở nên dẻo trong khoảng từ 100 đến 150 °C. Trên 210 °C, kẽm lại trở nên giòn và có thể bị nghiền vụn bằng cách đập. Kẽm dẫn điện ở mức trung bình. Đối với một kim loại, kẽm có nhiệt độ nóng chảy tương đối thấp (419,53 °C) và nhiệt độ sôi là 907 °C. Nhiệt độ nóng chảy này là thấp nhất trong số các kim loại thuộc khối d, ngoại trừ thủy ngân và cadimi. Chính vì lý do này (và một số yếu tố khác), kẽm, cadimi và thủy ngân thường không được xem là kim loại chuyển tiếp như các nguyên tố khác trong khối d.
Phân bố trong tự nhiên
Kẽm chiếm khoảng 70 ppm (0,007%) khối lượng vỏ Trái Đất, khiến nó trở thành nguyên tố phổ biến thứ 24 trong lớp vỏ Trái Đất. Kẽm cũng chiếm 312 ppm trong Hệ Mặt Trời, nơi nó là nguyên tố phổ biến thứ 22. Nồng độ kẽm nền điển hình không vượt quá: 1 μg/m3 trong khí quyển, 300 mg/kg trong đất, 100 mg/kg trong thảm thực vật, 20 μg/L trong nước ngọt và 5 μg/L trong nước biển.
Nguyên tố này thường được tìm thấy kết hợp với các kim loại cơ bản khác như đồng và chì dưới dạng quặng. Kẽm là một nguyên tố ưa kiềm, nghĩa là nguyên tố này có nhiều khả năng được tìm thấy kết hợp với lưu huỳnh và các nguyên tố chalcogen nặng khác, thay vì với oxy của nguyên tố chalcogen nhẹ hoặc với các nguyên tố có độ âm điện không phải là chalcogen như halogen.
Các sunfua của kẽm hình thành khi lớp vỏ Trái Đất nguội dần trong điều kiện khử mạnh của khí quyển thời kỳ Trái Đất sơ khai. Khoáng chất sphalerite (ZnS) – dạng tinh thể của kẽm sunfua – là quặng kẽm được khai thác nhiều nhất, vì nó chứa tới 60–62% kẽm theo khối lượng.
Đồng vị
Trong tự nhiên tồn tại năm đồng vị bền của kẽm, trong đó 64 Zn là đồng vị phổ biến nhất (chiếm 49,17% trong tự nhiên). Các đồng vị khác được tìm thấy trong tự nhiên là 66 Zn (27,73%), 67 Zn (4,04%), 68 Zn (18,45%) và 70Zn (0,61%). Hàng chục đồng vị phóng xạ đã được xác định. 65 Zn, có chu kỳ bán rã 243,66 ngày, là đồng vị phóng xạ kém hoạt động nhất, tiếp theo là 72 Zn với chu kỳ bán rã 46,5 giờ. Kẽm có 10 đồng phân hạt nhân, trong đó 69mZn có chu kỳ bán rã dài nhất, 13,75 giờ.
Hợp chất và tính chất hóa học
Tính phản ứng
Kẽm có cấu hình electron [Ar] 4s² 3d¹⁰ và thuộc nhóm 12 trong bảng tuần hoàn. Đây là kim loại có tính khử mạnh và hoạt động trung bình, đứng gần mangan (Mn) trong dãy hoạt động hóa học.
Bề mặt của kẽm nguyên chất dễ bị xỉn màu do phản ứng với carbon dioxide (CO₂) trong không khí, tạo nên lớp màng bảo vệ là kẽm cacbonat bazơ Zn₅(OH)₆(CO₃)₂, giúp ngăn quá trình oxy hóa sâu hơn.
Hợp chất kẽm(I)
Các hợp chất kẽm(I) rất hiếm. Ion [Zn₂]²⁺ được cho là tồn tại khi kẽm kim loại hòa tan trong ZnCl₂ nóng chảy, tạo thành thủy tinh màu vàng có tính nghịch từ.
Cấu trúc [Zn₂]²⁺ này tương tự [Hg₂]²⁺ trong các hợp chất thủy ngân(I), và tính nghịch từ của ion chứng minh rằng nó có dạng dimer (Zn–Zn). Năm 2004, hợp chất kẽm(I) đầu tiên chứa liên kết Zn–Zn thật sự đã được tổng hợp, có công thức (η⁵-C₅Me₅)₂Zn₂.
Hợp chất kẽm (II)
Hợp chất nhị phân của kẽm được biết đến với hầu hết các á kim và tất cả các phi kim, ngoại trừ khí hiếm. Oxit ZnO là một loại bột màu trắng, gần như không tan trong dung dịch nước trung tính, nhưng là chất lưỡng tính, tan trong cả dung dịch kiềm mạnh và dung dịch axit. Các chalcogenide khác (ZnS, ZnSe và ZnTe) có nhiều ứng dụng khác nhau trong điện tử và quang học. Các pnictogenide (Zn3N2, Zn3P2, Zn3As2 và Zn3Sb2), peroxide (ZnO2), hydride (ZnH2) và carbide (ZnC2) cũng được biết đến. Trong số bốn halogenua, ZnF2 có tính ion mạnh nhất, trong khi các halogenua khác (ZnCl2, ZnBr2 và ZnI2) có nhiệt độ nóng chảy tương đối thấp và được coi là có tính cộng hóa trị mạnh hơn.
Thử nghiệm kẽm
Giấy cobalticyanide (thử nghiệm Rinnmann cho Zn) có thể dùng làm chỉ thị hóa học cho kẽm. Hòa tan 4 g K₃Co(CN)₆ và 1 g KClO₃ trong 100 ml nước. Nhúng giấy vào dung dịch này và sấy khô ở 100 °C. Nhỏ một giọt mẫu lên giấy khô rồi đun nóng. Nếu xuất hiện đĩa màu xanh lá, điều đó chứng tỏ có kẽm.
Sản xuất kẽm
Khai thác và xử lý kẽm
Kẽm là kim loại phổ biến thứ tư trên thế giới, sau sắt, nhôm và đồng, với sản lượng hàng năm khoảng 13 triệu tấn. Nhà sản xuất kẽm lớn nhất thế giới là Nyrstar, một liên doanh giữa OZ Minerals (Úc) và Umicore (Bỉ). Khoảng 70% kẽm trên thế giới đến từ khai thác quặng, 30% còn lại từ tái chế kẽm thứ cấp. Kẽm tinh khiết thương mại được gọi là Special High Grade (SHG), có độ tinh khiết 99,995%.
Trên thế giới, 95% kẽm mới khai thác từ quặng sulfide, trong đó sphalerite (ZnS) thường pha trộn với sulfide của đồng, chì và sắt. Các mỏ kẽm trải rộng khắp thế giới, chủ yếu ở Trung Quốc, Úc và Peru. Năm 2014, Trung Quốc chiếm 38% sản lượng kẽm toàn cầu.
Kẽm được sản xuất bằng khai thác kim loại. Quặng được nghiền mịn. Tiến hành tách bọt để tách khoáng chất khỏi đá gangue dựa trên tính kỵ nước. Thu được quặng kẽm sulfide cô đặc, gồm khoảng: 50% kẽm, 32% lưu huỳnh, 13% sắt, 5% SiO
Tác động của kẽm đối môi trường
Việc tinh luyện quặng kẽm sunfua tạo ra một lượng lớn khí sulfur dioxide (SO₂) và hơi cadimi (Cd). Xỉ luyện kim và các chất thải khác chứa một lượng đáng kể kim loại. Từ năm 1806 đến 1882, khoảng 1,1 triệu tấn kẽm kim loại và 130 nghìn tấn chì đã được khai thác và luyện tại hai thị trấn La Calamine và Plombières của Bỉ.
Các bãi thải từ hoạt động khai khoáng trước đây vẫn rò rỉ kẽm và cadimi, khiến trầm tích ở sông Geul chứa một lượng kim loại đáng kể. Khoảng 2.000 năm trước, lượng phát thải kẽm từ khai thác và luyện kim vào khoảng 10.000 tấn mỗi năm.
Từ năm 1850, lượng phát thải tăng gấp 10 lần và đạt đỉnh 3,4 triệu tấn/năm vào những năm 1980, sau đó giảm xuống còn 2,7 triệu tấn/năm trong thập niên 1990, mặc dù một nghiên cứu năm 2005 về tầng đối lưu Bắc Cực cho thấy nồng độ tại đây không phản ánh sự suy giảm đó. Phát thải do con người tạo ra cao gấp 20 lần so với tự nhiên.
Nước sông chảy qua khu công nghiệp hoặc khu khai khoáng có thể chứa tới 20 ppm kẽm, nhưng xử lý nước thải hiệu quả giúp giảm đáng kể mức này — ví dụ, các biện pháp xử lý dọc sông Rhine đã hạ nồng độ xuống 50 ppb. Nồng độ kẽm chỉ 2 ppm cũng có thể ảnh hưởng xấu đến khả năng vận chuyển oxy trong máu của cá.
Đất bị ô nhiễm kẽm do khai thác, tinh luyện hoặc bón phân chứa bùn có kẽm có thể chứa vài gam kẽm trên mỗi kg đất khô. Khi vượt quá 500 ppm, kẽm làm giảm khả năng hấp thu các kim loại thiết yếu khác của cây như sắt và mangan. Một số mẫu đất ghi nhận nồng độ từ 2.000 ppm đến 180.000 ppm (tức 18%).
Ứng dụng của kẽm trong sản xuất
Tỷ lệ ứng dụng tại Hoa Kỳ:
- Mạ kẽm: 55%
- Đồng thau và đồng thiếc : 16%
- Các hợp kim khác: 21%
- Khác: 8%
Chống ăn mòn và pin
Kẽm được sử dụng phổ biến nhất như chất chống ăn mòn, với mạ kẽm (phủ sắt hoặc thép bằng kẽm) là dạng ứng dụng quen thuộc nhất. Năm 2009, tại Hoa Kỳ, 55% (tức 893.000 tấn) kẽm kim loại được dùng cho mục đích này.
Hợp kim
Đồng thau là hợp kim kẽm phổ biến, trong đó đồng được pha với 3–45% kẽm tùy loại. Đồng thau dẻo, bền và chống ăn mòn tốt hơn đồng nguyên chất, nên được ứng dụng trong thiết bị truyền thông, phần cứng, nhạc cụ, và van nước.
Ứng dụng công nghiệp khác
Khoảng 25% sản lượng kẽm của Hoa Kỳ (2009) được sử dụng để sản xuất các hợp chất kẽm phục vụ công nghiệp.
- Kẽm oxit (ZnO) là chất màu trắng trong sơn và là xúc tác trong sản xuất cao su, giúp tản nhiệt.
- ZnO còn giúp bảo vệ nhựa và cao su khỏi tia UV.
Thực phẩm chức năng từ Kẽm (Zinc)
Trong hầu hết các viên nén đơn, không kê đơn, thực phẩm chức năng bổ sung vitamin và khoáng chất hàng ngày, kẽm được bổ sung dưới các dạng như kẽm oxit, kẽm axetat, kẽm gluconat hoặc kẽm chelate axit amin.
Hỗ trợ điều trị khi mắc bệnh tiêu chảy
Kẽm là phương pháp điều trị hiệu quả, chi phí thấp cho tiêu chảy ở trẻ em tại các nước đang phát triển. Khi bị tiêu chảy, lượng kẽm trong cơ thể giảm; việc bổ sung trong 10–14 ngày có thể rút ngắn thời gian và mức độ nghiêm trọng của bệnh, đồng thời giảm khả năng tái phát trong 3 tháng tiếp theo.
Cảm lạnh thông thường
Các viên ngậm hoặc bổ sung kẽm (zinc acetate, zinc gluconate) được dùng để giảm thời gian cảm lạnh. Dù không ngăn ngừa cảm lạnh, kẽm có thể rút ngắn thời gian bệnh, nhưng ít ảnh hưởng đến mức độ triệu chứng.
Tăng cân
Thiếu kẽm có thể gây mất cảm giác thèm ăn. Kẽm đã được đề xuất điều trị chứng biếng ăn từ năm 1979. Ít nhất 15 thử nghiệm lâm sàng chứng minh kẽm giúp tăng cân ở bệnh nhân chán ăn. Một nghiên cứu năm 1994 cho thấy kẽm tăng gấp đôi tốc độ tăng khối lượng cơ thể ở người mắc biếng ăn tâm thần. Thiếu các chất khác như tyrosine, tryptophan và thiamine cũng góp phần gây ra tình trạng “suy dinh dưỡng do suy dinh dưỡng”.
Dạng bôi ngoài da
Các chế phẩm chứa kẽm, đặc biệt là zinc oxide, được dùng để bảo vệ da. ZnO được FDA công nhận là an toàn và hiệu quả, có độ bền quang học cao và là thành phần phổ biến trong kem chống nắng. Khi bôi mỏng lên vùng da tã của trẻ sơ sinh, ZnO giúp ngăn ngừa hăm tã.
Nhờ tính chất bán dẫn, zinc oxide được sử dụng trong điện trở phụ thuộc điện áp và thiết bị sao chụp.
Chu trình kẽm – kẽm oxit là một quy trình nhiệt hóa hai bước dựa trên kẽm và oxit kẽm, dùng để sản xuất hydro.