Titan là gì? Ứng dụng và quy trình tinh chế Titanium
Titan là gì?
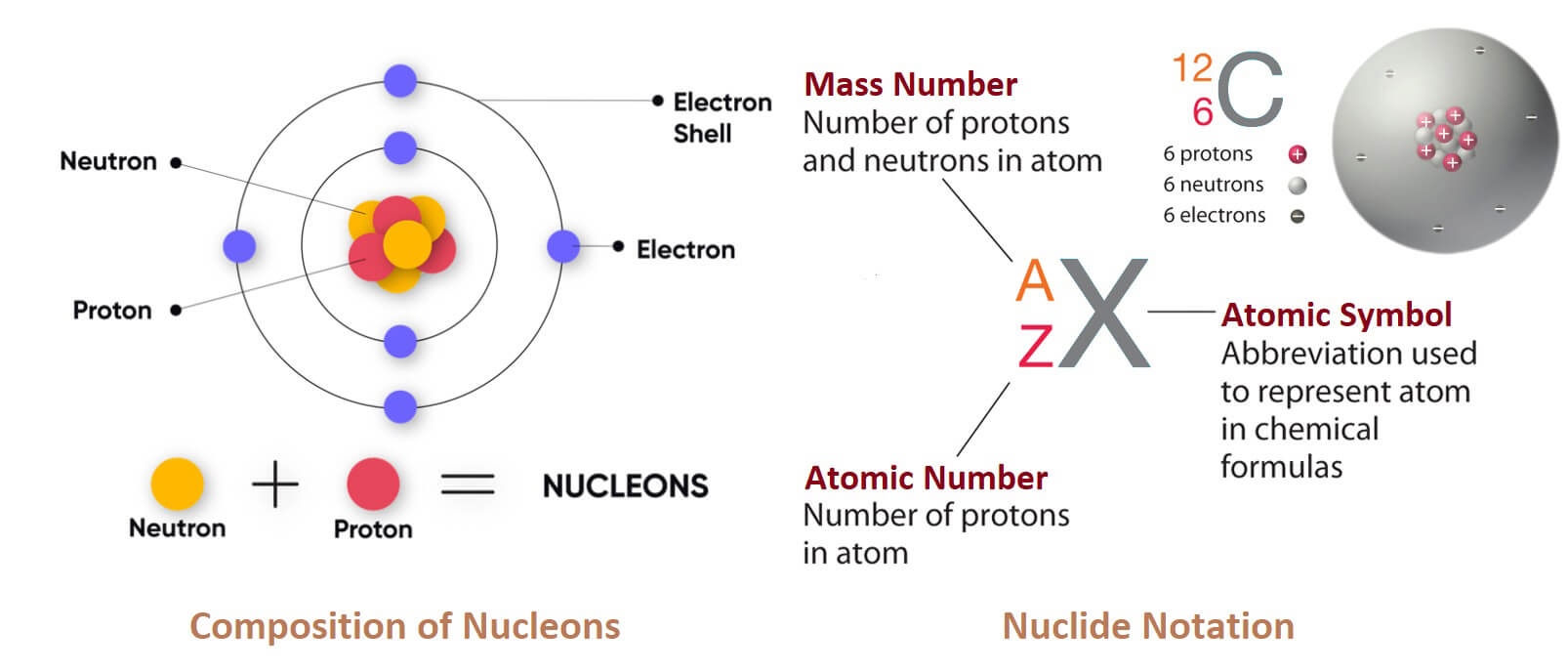
“Titan” trong tiếng Anh là Titanium. Phát âm là /tʌɪˈteɪniəm/ (ty-TAY-nee-əm) hay /təˈteɪniəm/ (tə-TAY-nee-əm). Titan là một nguyên tố hóa học, ký hiệu Ti và số hiệu nguyên tử là 22 (Z=22). Trong tự nhiên, titan chỉ tồn tại dưới dạng oxit, có thể khử thành kim loại chuyển tiếp sáng bóng, màu bạc, khối lượng riêng thấp và độ bền cao, có khả năng chống ăn mòn trong nước biển, nước cường toan và clo.
Bảng thông tin nguyên tố Titanium (Ti)
| Titan trong bảng tuần hoàn hóa học | |
| Vị trí | Đứng trước Ziriconi trong nhóm 4 Đứng giữa Scadium và Vanadium trong chu kỳ 4 |
| Nguyên tử khối | 47.867 ± 0.001 47.867 ± 0.001 (rút gọn) |
| Số nguyên tử (Z) | 22 |
| Nhóm | Nhóm 4 |
| Chu kỳ | Chu kỳ 4 |
| Khối | Khối d |
| Cấu hình electron | [Ar] 3d² 4s² |
| Số electron trên mỗi lớp | 2, 8, 10, 2 |
| Tính chất vật lý | |
| Trạng thái ở điều kiện tiêu chuẩn (STP) | Chất Rắn |
| Nhiệt độ nóng chảy | 1941 K (1668 °C; 3034 °F) |
| Nhiệt độ sôi | 3560 K (3287 °C; 5949 °F) |
| Khối lượng riêng (20 °C) | 4.502 g/cm³ |
| Khối lượng riêng (khi nóng chảy) | 4.11 g/cm³ |
| Nhiệt nóng chảy | 14.15 kJ/mol |
| Nhiệt hóa hơi | 425 kJ/mol |
| Nhiệt dung mol | 25.060 J/(mol·K) |
| Áp suất hơi | ||||||
| Áp suất P (Pa) | 1 | 10 | 100 | 1k | 10k | 100k |
| Nhiệt độ T (K) | 1982 | 2171 | (2403) | 2692 | 3064 | 3558 |
| Tính chất nguyên tử | |
| Trạng thái oxi hóa | Phổ biến: +4 Khác: −2, −1, 0, +1, +2, +3 |
| Độ âm điện | Thang Pauling: 1.54 |
| Năng lượng ion hóa | Lần thứ nhất: 658.8 kJ/mol Lần thứ 2: 1309.8 kJ/mol Lần thứ 3: 2652.5 kJ/mol |
| Bán kính nguyên tử | Thực nghiệm: 147 pm |
| Bán kính cộng hóa trị | 160 ± 8 pm |
| Các tính chất khác | |
| Nguồn gốc tự nhiên | nguyên thủy |
| Cấu trúc tinh thể | lục giác xếp chặt (hexagonal close-packed, hcp) |
| Hằng số mạng tinh thể | a = 295.05 pm c = 468.33 pm (ở 20 °C) |
| Hệ số giãn nở nhiệt | 9.68 × 10⁻⁶ /K (ở 20 °C) |
| Độ dẫn nhiệt | 21.9 W/(m·K) |
| Điện trở suất | 420 nΩ·m (ở 20 °C) |
| Trật tự từ tính | thuận từ (paramagnetic) |
| Độ từ hóa mol | 153.0 × 10⁻⁶ cm³/mol (293 K) |
| Mô-đun Young | 116 GPa |
| Mô-đun cắt | 44 GPa |
| Mô-đun khối | 110 GPa |
| Tốc độ âm trong thanh titan | 5090 m/s (ở nhiệt độ phòng) |
| Tỉ số Poisson | 0.32 |
| Độ cứng Mohs | 6.0 |
| Độ cứng Vickers | 830–3420 MPa |
| Độ cứng Brinell | 716–2770 MPa |
| CAS Number | 7440-32-6 |
| Lịch sử | |
| Tên gọi | đặt theo các Titan trong thần thoại Hy Lạp |
| Khám phá | William Gregor (1791) |
| Tách biệt đầu tiên | Jöns Jakob Berzelius (1825) |
| Đặt tên bởi | Martin Heinrich Klaproth (1795) |
| Các đồng vị của titan | |||||
| Đồng vị chính | Phân rã | ||||
| Đồng vị | Nguồn gốc | Độ phổ biến | Chu kỳ bán rã | Kiểu phân rã | Sản phẩm |
| ⁴⁴Ti | Tổng hợp | — | 59.1 năm | ε | ⁴⁴Sc |
| ⁴⁵Ti | Tổng hợp | — | 3.08 giờ | β⁺ | ⁴⁵Sc |
| ⁴⁶Ti | Tự nhiên | 8.25% | Bền | ||
| ⁴⁷Ti | Tự nhiên | 7.44% | Bền | ||
| ⁴⁸Ti | Tự nhiên | 73.73% | Bền | ||
| ⁴⁹Ti | Tự nhiên | 5.41% | Bền | ||
| ⁵⁰Ti | Tự nhiên | 5.18% | Bền | ||
Lịch sử của titan
Lịch sử của titan là một hành trình đầy hấp dẫn bắt nguồn từ đầu thế kỷ 19. Năm 1791, nhà hóa học người Anh William Gregor tình cờ phát hiện ra kim loại đặc biệt này khi đang nghiên cứu khoáng chất ilmenit, đặt nền móng cho tương lai của nó. Đến năm 1910, nhà hóa học người Mỹ Matthew Hunter đã đạt được một cột mốc quan trọng khi lần đầu tiên sản xuất được titan nguyên chất, một khoảnh khắc then chốt trong lịch sử của kim loại này, kết nối chúng ta với quá khứ của nó.
Ngày nay, titan được sản xuất bằng quy trình Kroll, một phương pháp được William Kroll phát triển vào những năm 1930. Quy trình này bắt đầu bằng việc khai thác và tinh chế quặng titan như rutil hoặc ilmenit. Nó cũng bao gồm việc tinh chế titan tetraclorua lỏng (TiCl₄) và chuyển đổi quặng thành hợp chất này. Kết quả là một miếng bọt biển titan, được nấu chảy và định hình thành thỏi hoặc các dạng khác để sử dụng trong nhiều sản phẩm khác nhau.
Những đặc tính độc đáo và hấp dẫn của nó khiến nó vừa bền chắc vừa nhẹ, không bị ăn mòn và tương thích sinh học. Những đặc tính đặc biệt này đã khiến kim loại này trở nên không thể thiếu trong nhiều ngành công nghiệp, từ hàng không vũ trụ và quốc phòng đến y tế và hàng tiêu dùng. Tính linh hoạt tuyệt đối của Titan, được thúc đẩy bởi những lợi ích này, đã truyền cảm hứng cho sự đổi mới và tiến bộ công nghệ trong nhiều lĩnh vực.
Đặc tính
Tính chất vật lý
Là một kim loại, Titan được biết đến nhờ tỷ lệ độ bền trên trọng lượng cao. Đây là một kim loại cứng với mật độ thấp, khá dẻo (đặc biệt là trong môi trường không có oxy), sáng bóng và có màu trắng kim loại. Do nhiệt độ nóng chảy tương đối cao (1.668 °C hoặc 3.034 °F), đôi khi nó được mô tả là kim loại chịu lửa, nhưng điều này không đúng. Titan có tính thuận từ, độ dẫn điện và dẫn nhiệt khá thấp so với các kim loại khác. Titan trở nên siêu dẫn khi được làm lạnh xuống dưới nhiệt độ tới hạn 0,49 K.
Các loại titan tinh khiết thương mại (99,2% tinh khiết) có độ bền kéo cực đại khoảng 434 MPa (63.000 psi), tương đương với các hợp kim thép thông thường, cấp thấp, nhưng ít đặc hơn. Titan đặc hơn nhôm 60% nhưng bền hơn gấp đôi so với hợp kim nhôm 6061-T6 được sử dụng phổ biến nhất. Một số hợp kim titan (ví dụ: Beta C) đạt độ bền kéo trên 1.400 MPa (200.000 psi). Tuy nhiên, titan mất độ bền khi nung nóng trên 430 °C (806 °F).
Tính chất hóa học
Giống như nhôm và magiê, bề mặt kim loại titan và các hợp kim của nó bị oxy hóa ngay lập tức khi tiếp xúc với không khí, tạo thành một lớp thụ động mỏng, không xốp, bảo vệ kim loại khối khỏi quá trình oxy hóa hoặc ăn mòn tiếp theo.
Khi mới hình thành, lớp bảo vệ này chỉ dày 1–2 nm nhưng tiếp tục phát triển chậm, đạt độ dày 25 nm sau bốn năm.
Lớp này mang lại cho titan khả năng chống ăn mòn tuyệt vời đối với các axit oxy hóa, nhưng nó sẽ hòa tan trong axit flohydric loãng, axit clohydric nóng và axit sunfuric nóng.
Ở nhiệt độ phòng, titan khá trơ với halogen nhưng sẽ kết hợp mạnh với clo và brom ở 550 °C (1.022 °F) để tạo thành titan tetraclorua và titan tetrabromua.
Titan dễ dàng phản ứng với oxy ở 1.200 °C (2.190 °F) trong không khí và ở 610 °C (1.130 °F) trong oxy nguyên chất, tạo thành titan dioxit.
Oxit này cũng được hình thành bởi phản ứng giữa titan và oxy nguyên chất ở nhiệt độ phòng và áp suất 25 bar (2.500 kPa).
Titan là một trong số ít nguyên tố cháy trong khí nitơ nguyên chất, phản ứng ở 800 °C (1.470 °F) tạo thành titan nitrua, gây ra hiện tượng giòn.
Xuất hiện
Titan là nguyên tố phổ biến thứ chín trong vỏ Trái Đất (0,63% khối lượng) và là kim loại phổ biến thứ bảy. Nó hiện diện dưới dạng oxit trong hầu hết các loại đá macma, trong trầm tích có nguồn gốc từ chúng, trong các sinh vật sống và các vùng nước tự nhiên. Trong số 801 loại đá macma được Cục Khảo sát Địa chất Hoa Kỳ phân tích, 784 loại có chứa titan. Tỷ lệ titan trong đất khoảng 0,5–1,5%.
Nồng độ titan trong đại dương khoảng 4 picomolar. Ở 100 °C, nồng độ titan trong nước ước tính nhỏ hơn 10−7 M ở pH 7
Titan có trong thiên thạch và nó đã được phát hiện trên Mặt Trời và trong các ngôi sao loại M (loại lạnh nhất) với nhiệt độ bề mặt là 3.200 °C (5.790 °F). Đá được mang về từ Mặt Trăng trong sứ mệnh Apollo 17 có thành phần 12,1% TiO2. Titan tự nhiên chỉ được tìm thấy trong các loại đá chịu áp suất từ khoảng 2,8 đến 4,0 gigapascal trên Trái Đất, nhưng nó đã được phát hiện trong các tinh thể nano trên Mặt Trăng.
Đồng vị
Titan tự nhiên bao gồm năm đồng vị bền: 46Ti, 47Ti, 48Ti, 49Ti và 50Ti, trong đó 48Ti là đồng vị phổ biến nhất (chiếm 73,8% trong tự nhiên). Có 23 đồng vị phóng xạ đã được xác định, trong đó bền nhất là 44Ti với chu kỳ bán rã 63 năm; 45Ti, 184,8 phút; 51Ti, 5,76 phút và 52Ti, 1,7 phút. Tất cả các đồng vị phóng xạ còn lại đều có chu kỳ bán rã dưới 33 giây, phần lớn dưới 0,5 giây.
Hợp chất
Oxit, sunfuades và alkoxide
Oxit quan trọng nhất là TiO₂, tồn tại ở ba dạng quan trọng: anatase, brookite và rutile. Cả ba đều là chất rắn nghịch từ màu trắng, mặc dù các mẫu khoáng vật có thể có màu tối (như rutile). Chúng có cấu trúc polyme, trong đó Ti được bao quanh bởi sáu phối tử oxit liên kết với các tâm Ti khác.
Nitrua và cacbua
Titan nitride (TiN) là một chất rắn chịu lửa có độ cứng cực cao, độ dẫn nhiệt/điện và điểm nóng chảy cao. TiN có độ cứng tương đương với sapphire và carborundum (9,0 trên thang Mohs) và thường được sử dụng để phủ các dụng cụ cắt, chẳng hạn như mũi khoan. Nó cũng được sử dụng làm lớp hoàn thiện trang trí màu vàng và làm lớp chắn trong chế tạo chất bán dẫn. Titan cacbua (TiC) cũng rất cứng, được tìm thấy trong các dụng cụ cắt và lớp phủ.
Halogenua
Titan tetraclorua (titan(IV) clorua, TiCl₄) là một chất lỏng dễ bay hơi không màu (các mẫu thương mại có màu hơi vàng) thủy phân trong không khí tạo ra những đám mây trắng tuyệt đẹp. Thông qua quy trình Kroll, TiCl4 được sử dụng để chuyển đổi quặng titan thành kim loại titan.
Các hợp chất organometallic
Do vai trò quan trọng của các hợp chất titan như chất xúc tác trùng hợp, các hợp chất có liên kết Ti-C đã được nghiên cứu chuyên sâu. Hợp chất organometalium phổ biến nhất là titanocen dichloride ((C₅H₅)₂TiCl₂). Các hợp chất liên quan bao gồm thuốc thử Tebbe và thuốc thử Petasis. Titan tạo thành các phức chất cacbonyl, ví dụ: (C₅H₅)₂Ti(CO)₂.
Sản xuất
Sản xuất titan chủ yếu được chia thành ba loại: sản xuất “bọt biển” kim loại titan xốp, bột màu oxit titan và tinh quặng titan dùng để sản xuất bọt biển, bột màu, thỏi kim loại và các sản phẩm titan khác như lớp phủ. Các tinh quặng này chủ yếu bao gồm khoáng ilmenit, nhưng cũng bao gồm anatase, rutil tự nhiên và tổng hợp, quặng đuôi, xỉ và leucoxene. Tính đến năm 2024, các nhà sản xuất tinh quặng titan lớn nhất là Trung Quốc, Mozambique và Nam Phi.
Quy trình tuyển khoáng
Một số quy trình đã được phát triển để chiết xuất titan và các khoáng chất có chứa titan có thể sử dụng từ quặng. Quy trình Becher là một quy trình công nghiệp được sử dụng để sản xuất rutil tổng hợp, một dạng titan dioxit, từ quặng ilmenit bằng cách loại bỏ sắt. Quy trình này không được sử dụng ở quy mô lớn. Quy trình clorua tạo ra titan tetraclorua thông qua việc xử lý quặng rutil bằng clo và cacbon ở nhiệt độ cao, sau đó oxy hóa sản phẩm bằng ngọn lửa oxy hoặc plasma để tạo ra titan dioxit.
Quy trình tinh chế
Quy trình Hunter
Quy trình Hunter là quy trình công nghiệp đầu tiên sản xuất titan kim loại tinh khiết. Nó được phát minh vào năm 1910 bởi Matthew A. Hunter, một nhà hóa học sinh ra ở New Zealand và làm việc tại Hoa Kỳ. Quy trình này bao gồm việc khử titan tetraclorua (TiCl₄) bằng natri (Na) trong lò phản ứng theo mẻ với môi trường trơ ở nhiệt độ 1.000 °C. Sau đó, axit clohydric loãng được sử dụng để chiết xuất muối từ sản phẩm.
Quy trình Kroll
Quá trình chế biến kim loại titan diễn ra qua bốn bước chính: khử quặng titan thành “bọt biển”, một dạng xốp; nấu chảy bọt biển, hoặc bọt biển cộng với hợp kim chính để tạo thành thỏi; chế tạo sơ cấp, trong đó thỏi được chuyển đổi thành các sản phẩm cán tổng hợp như phôi, thanh, tấm, lá, dải và ống; và chế tạo thứ cấp các hình dạng hoàn thiện từ các sản phẩm cán.
Quy trình Arkel-Boer
Quy trình van Arkel–de Boer là quy trình bán công nghiệp đầu tiên được phát triển để sản xuất titan nguyên chất, được Anton Eduard van Arkel và Jan Hendrik de Boer phát minh vào năm 1925 cho công ty điện tử Philips. Đây là một quy trình khép kín liên quan đến quá trình phân hủy nhiệt của titan tetraiodide.
Quy trình Armstrong
Bột titan được sản xuất bằng quy trình sản xuất dòng chảy được gọi là quy trình Armstrong, tương tự như quy trình Hunter sản xuất hàng loạt. Một luồng khí titan tetraclorua được thêm vào luồng natri nóng chảy; sản phẩm (muối natri clorua và các hạt titan) được lọc khỏi natri dư. Sau đó, titan được tách khỏi muối bằng cách rửa nước. Cả natri và clo đều được tái chế để sản xuất và xử lý thêm titan tetraclorua.
Tính chất cơ học của titan là gì?
Titan là một kim loại bền chắc mà nhiều ngành công nghiệp dựa vào nhờ các tính chất cơ học quan trọng của nó.
Tính tương thích sinh học và tích hợp xương
Titan thường được sử dụng trong y học để cấy ghép, cố định nha khoa và các thiết bị khác vì nó tương thích tốt với cơ thể. Một đặc điểm độc đáo của vật liệu này là khả năng liên kết với mô xương, một quá trình gọi là tích hợp xương. Cấy ghép trở thành một phần của cơ thể và tạo thành một liên kết chắc chắn với xương, giúp bệnh nhân lành vết thương nhanh hơn và cải thiện sức khỏe.
Khả năng chống ăn mòn
Titan cũng có khả năng chống ăn mòn rất tốt. Nó tạo thành một lớp mỏng bảo vệ trên bề mặt, bảo vệ nó khỏi hóa chất, ngay cả trong điều kiện khắc nghiệt, khiến nó trở thành một lựa chọn tốt cho các ứng dụng hàng hải, xử lý hóa chất và cấy ghép y tế.
Tỷ lệ sức bền trên trọng lượng
Titan bền nhưng nhẹ. Nó gần như bền bằng thép nhưng nhẹ hơn 45%, điều này rất quan trọng khi trọng lượng là yếu tố quyết định. Tỷ lệ bền/trọng lượng này giúp tạo ra các sản phẩm cho lĩnh vực hàng không vũ trụ, ô tô và y tế.
Khả năng chịu nhiệt và chịu lạnh
Titan vẫn bền và dẻo dai trong điều kiện nhiệt độ cực cao và cực thấp. Nhờ khả năng chịu được nhiệt độ cao và thấp, titan phù hợp để sử dụng trong ngành hàng không vũ trụ, năng lượng và công nghiệp.
Các loại titan và hợp kim nào phổ biến?
Titan là vật liệu bền và nhẹ được sử dụng trong nhiều ngành công nghiệp, chẳng hạn như hàng không vũ trụ, quốc phòng, y tế và các sản phẩm tiêu dùng. Nó phổ biến vì an toàn cho cơ thể, không bị gỉ sét và rất bền so với trọng lượng của nó.
Titan tinh khiết thương mại (CP)
Titan CP là dạng tinh khiết nhất, chứa rất ít nguyên tố hợp kim. Có bốn cấp (Cấp 1-4) dựa trên mức độ tạp chất và oxy. Titan CP được đánh giá cao vì khả năng chống ăn mòn tuyệt vời. Các ứng dụng trong ngành y tế bao gồm cấy ghép y tế, thiết bị xử lý hóa chất và các ứng dụng hàng hải.
Hợp kim Titan
Hợp kim titan cải thiện các đặc tính của chúng bằng cách thêm một lượng nhỏ các nguyên tố khác như nhôm, vanadi, molypden hoặc crom. Hơn nữa, một số hợp kim được sử dụng rộng rãi nhất bao gồm:
Ti-6Al-4V
Hợp kim titan này được sử dụng rộng rãi nhờ sự kết hợp cân bằng giữa độ bền, khả năng chống ăn mòn và khả năng định hình, khiến nó trở nên phổ biến trong các ứng dụng hàng không vũ trụ, y tế và công nghiệp.
Ti-6Al-2Sn-4Zr-2Mo
Hợp kim này được biết đến với độ bền cao và khả năng chống rão, phù hợp cho các bộ phận động cơ phản lực và các ứng dụng nhiệt độ cao khác.
Ti-3Al-2.5V
Hợp kim này được biết đến với độ dẻo tuyệt vời và thường được sử dụng để sản xuất ống liền mạch, đường ống thủy lực và nhiên liệu, cũng như các ứng dụng khác đòi hỏi khả năng định hình.
Ti-5Al-2.5Sn
Được biết đến với độ bền cao, khả năng chống rão tuyệt vời và khả năng hàn tuyệt vời, khiến nó trở thành một lựa chọn phổ biến CE cho các bộ phận động cơ máy bay, động cơ tên lửa và các ứng dụng hàng không vũ trụ khác.
Ứng dụng của Titan
Titan được sử dụng trong thép như một nguyên tố hợp kim (ferro-titan) để giảm kích thước hạt và làm chất khử oxy; sử dụng trong thép không gỉ để giảm hàm lượng cacbon.
Titan thường được hợp kim hóa với nhôm (để tinh chỉnh kích thước hạt), vanadi, đồng (để làm cứng), sắt, mangan, molypden và các kim loại khác.
Các sản phẩm cán titan (tấm, tấm, thanh, dây, rèn, đúc) được ứng dụng trong công nghiệp, hàng không vũ trụ, giải trí và các thị trường mới nổi. Titan dạng bột được sử dụng trong pháo hoa như một nguồn tạo ra các hạt cháy sáng.
Sắc tố, phụ gia và lớp phủ
Titan dioxit (TiO₂) là hợp chất phổ biến nhất của nguyên tố này, là thành phần cuối cùng của 95% titan tinh chế trên thế giới. Nó là một sắc tố trắng được sử dụng rộng rãi. Nó cũng được sử dụng trong xi măng, đá quý và làm chất làm mờ quang học trong giấy.
Hàng không vũ trụ và hàng hải
Do hợp kim titan có tỷ lệ độ bền kéo trên mật độ cao, khả năng chống ăn mòn, chống mỏi, chống nứt cao và khả năng chịu được nhiệt độ khá cao mà không bị biến dạng, chúng được sử dụng trong máy bay, lớp vỏ bọc thép, tàu hải quân, tàu vũ trụ và tên lửa.
Công nghiệp
Ống titan hàn và thiết bị xử lý (bộ trao đổi nhiệt, bồn chứa, bình xử lý, van) được sử dụng trong các ngành công nghiệp hóa chất và hóa dầu chủ yếu để chống ăn mòn. Các hợp kim đặc biệt được sử dụng trong các ứng dụng giếng khoan dầu khí và luyện kim niken nhờ độ bền cao (ví dụ: hợp kim titan beta C), khả năng chống ăn mòn hoặc cả hai.
Tiêu dùng và kiến trúc
Kim loại titan được sử dụng trong các ứng dụng ô tô, đặc biệt là trong đua xe ô tô và xe máy, nơi trọng lượng nhẹ, độ bền và độ cứng cao là rất quan trọng. Kim loại này thường quá đắt đối với thị trường tiêu dùng nói chung, mặc dù một số mẫu Corvette đời mới đã được sản xuất với ống xả titan.
Trang sức
Do độ bền cao, titan được sử dụng trong một số đồ trang sức thiết kế, chẳng hạn như nhẫn titan. Tính trơ của titan giúp nó không gây dị ứng và có thể đeo được trong môi trường như hồ bơi. Titan cũng được hợp kim hóa với vàng để tạo ra một hợp kim có thể được bán trên thị trường dưới dạng vàng 24 karat, vì 1% Ti hợp kim không đủ để yêu cầu một mức độ đánh dấu thấp hơn. Hợp kim thu được có độ cứng tương đương vàng 14 karat và bền hơn vàng 24 karat nguyên chất.
Y tế
Do titan tương thích sinh học (không độc hại và không bị cơ thể đào thải), nó có nhiều ứng dụng trong y tế, bao gồm dụng cụ phẫu thuật và cấy ghép, chẳng hạn như khớp háng và ổ cối (thay khớp) và cấy ghép nha khoa.
Các nghiên cứu về liệu pháp chống ung thư
Sau thành công của hóa trị liệu dựa trên bạch kim, các phức hợp titan(IV) là một trong những hợp chất không phải bạch kim đầu tiên được thử nghiệm và chấp nhận cho các thử nghiệm lâm sàng trong điều trị ung thư.
Lưu trữ chất thải hạt nhân
Do khả năng chống ăn mòn, các thùng chứa làm bằng titan đã được nghiên cứu để lưu trữ chất thải hạt nhân lâu dài. Các thùng chứa có tuổi thọ hơn 100.000 năm được cho là có thể với điều kiện sản xuất giảm thiểu khuyết tật vật liệu.
Nguy cơ và mức an toàn
Titan không độc hại, ngay cả với liều lượng lớn và không đóng bất kỳ vai trò tự nhiên nào bên trong cơ thể con người. Ước tính con người tiêu thụ khoảng 0,8 miligam titan mỗi ngày, nhưng hầu hết đi qua hệ tiêu hóa mà không được hấp thụ vào các mô.
Ở dạng bột hoặc dạng vụn kim loại, kim loại titan gây ra nguy cơ hỏa hoạn đáng kể. Khi được nung nóng trong không khí, có thể gây nổ.
Nước và carbon dioxide không hiệu quả trong việc dập tắt đám cháy titan. Phải sử dụng các chất chữa cháy dạng bột khô Loại D thay thế.
Khi được sử dụng trong sản xuất hoặc xử lý clo, titan tiếp xúc với khí clo khô có thể gây ra đám cháy titan-clo.
Titan cũng có thể bắt lửa khi một bề mặt mới, chưa bị oxy hóa tiếp xúc với oxy lỏng.