Chì là gì? Ứng dụng của Lead trong công nghiệp
Chì là gì?
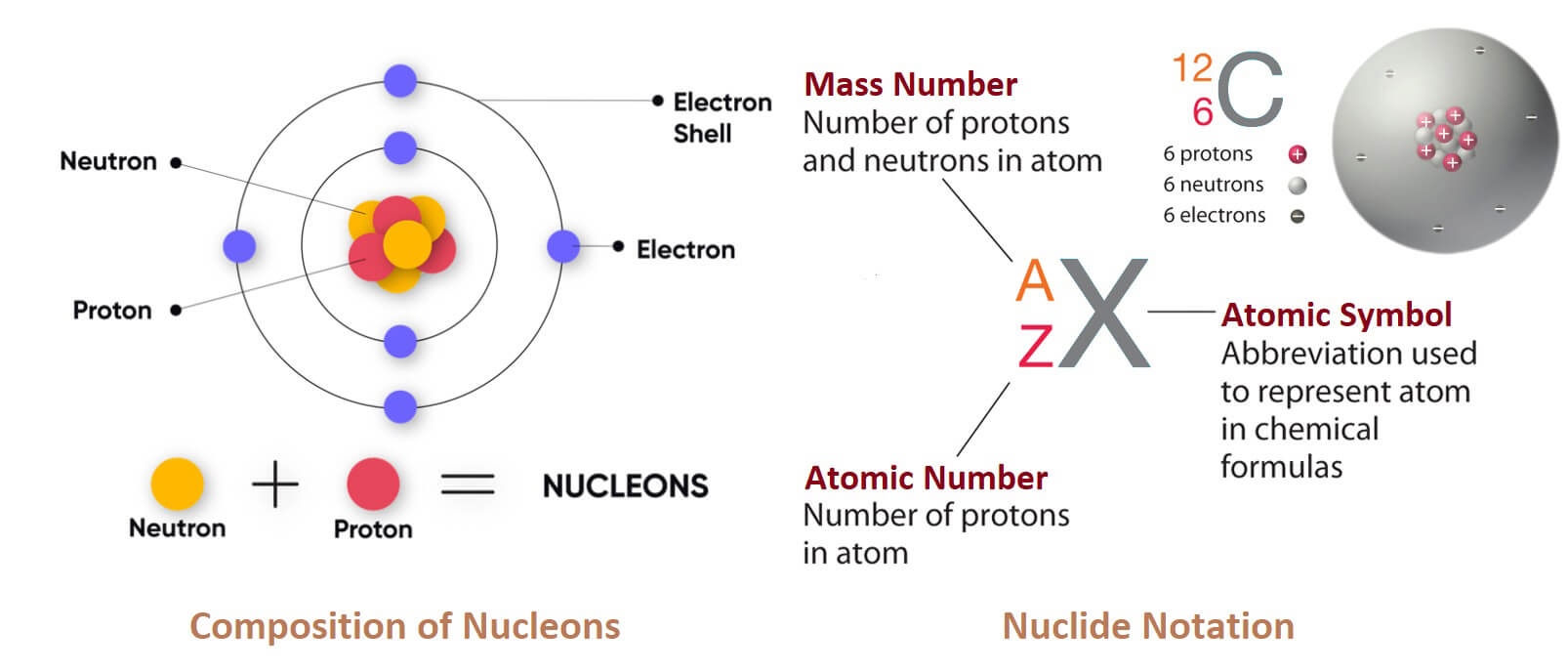
Chì (lead) là một nguyên tố hóa học có ký hiệu Pb (bắt nguồn từ tiếng Latinh plumbum) và số nguyên tử 82. Nó là một kim loại nặng, đặc hơn hầu hết các vật liệu thông thường. Chì mềm, dễ uốn và có nhiệt độ nóng chảy tương đối thấp. Khi mới cắt, chì có màu xám bóng với ánh xanh lam, nhưng bị xỉn màu thành xám xỉn khi tiếp xúc với không khí. Chì có số hiệu nguyên tử cao nhất trong số các nguyên tố bền, và ba đồng vị của nó là điểm cuối của các chuỗi phân rã hạt nhân chính của các nguyên tố nặng hơn.
| Chì, 82Pb | |
| Tính chất chung | |
| Tên, ký hiệu | Chì, Pb |
| Phiên âm | /ˈlɛd/ led |
| Hình dạng | Ánh kim xám |
| Chì trong bảng tuần hoàn | |
| Sn ↑ Pb ↓ Fl Thali ← Chì → Bismuth |
|
| Số nguyên tử (Z) | 82 |
| Khối lượng nguyên tử chuẩn (Ar) | 207,2 |
| Phân loại | kim loại yếu |
| Nhóm, phân lớp | 14, p |
| Chu kỳ | Chu kỳ 6 |
| Cấu hình electron | [Xe] 4f14 5d10 6s2 6p2 |
| mỗi lớp | 2, 8, 18, 32, 18, 4 |
| Tính chất vật lý | |
| Màu sắc | Ánh kim xám |
| Trạng thái vật chất | Chất rắn |
| Nhiệt độ nóng chảy | 600,61 K (327,46 °C, 621,43 °F) |
| Nhiệt độ sôi | 2022 K (1749 °C, 3180 °F) |
| Mật độ | 11,34 g·cm−3 (ở 0 °C, 101.325 kPa) |
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 10,66 g·cm−3 |
| Nhiệt lượng nóng chảy | 4,77 kJ·mol−1 |
| Nhiệt bay hơi | 179,5 kJ·mol−1 |
| Nhiệt dung | 26,650 J·mol−1·K−1 |
| Áp suất hơi | ||||||
| P (Pa) | 1 | 10 | 100 | 1k | 10k | 100k |
| at T (K) | 978 | 1088 | 1229 | 1412 | 1660 | 2027 |
| Tính chất nguyên tử | |
| Trạng thái oxy hóa | 4, 2 Lưỡng tính |
| Độ âm điện | 2,33 (Thang Pauling) |
| Năng lượng ion hóa | Thứ nhất: 715,6 kJ·mol−1 Thứ hai: 1450,5 kJ·mol−1 Thứ ba: 3081,5 kJ·mol−1 |
| Bán kính cộng hoá trị | thực nghiệm: 175 pm |
| Bán kính liên kết cộng hóa trị | 146±5 pm |
| Bán kính van der Waals | 202 pm |
| Thông tin khác | |
| Cấu trúc tinh thể | Lập phương tâm mặt |
| Độ giãn nở nhiệt | 28,9 µm·m−1·K−1 (ở 25 °C) |
| Độ dẫn nhiệt | 35,3 W·m−1·K−1 |
| Điện trở suất | ở 20 °C: 208 n Ω·m |
| Tính chất từ | Nghịch từ |
| Mô đun Young | 16 GPa |
| Mô đun cắt | 5,6 GPa |
| Mô đun khối | 46 GPa |
| Hệ số Poisson | 0,44 |
| Độ cứng theo thang Mohs | 1,5 |
| Độ cứng theo thang Brinell | 38,3 MPa |
| Số đăng ký CAS | 7439-92-1 |
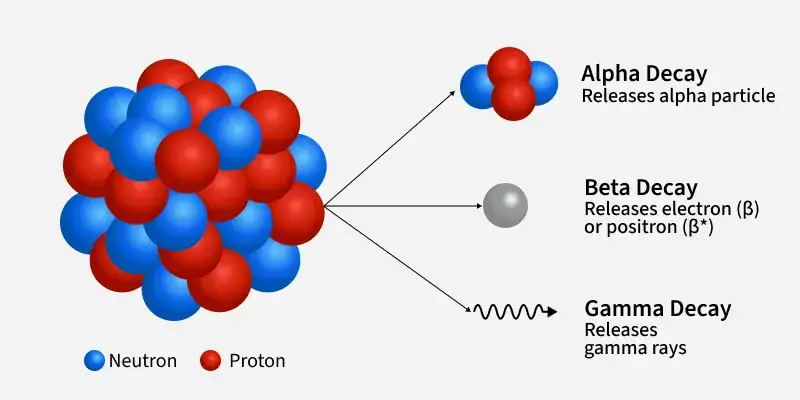
| Đồng vị của Chì | |||||
| Iso | NA | Chu kỳ bán rã | DM | DE (MeV) | DP |
| 202Pb | Tổng hợp | 5,25×104 năm | ε | – | 202Tl |
| 204Pb | 1.4% | 204Pb ổn định với 122 neutron[1] | |||
| 205Pb | Vết | 1,53×107 năm | ε | 51 | 205Tl |
| 206Pb | 24.1% | 206Pb ổn định với 124 neutron[2] | |||
| 207Pb | 22.1% | 207Pb ổn định với 125 neutron[3] | |||
| 208Pb | 52.4% | 208Pb ổn định với 126 neutron[4] | |||
| 209Pb | Vết | 3,253 giờ | β- | – | 209Bi |
|
210Pb
|
Vết
|
22,2 năm
|
β- | 64 | 210Bi |
| α | 3.792 | 206Hg | |||
| 211Pb | Vết | 36,1 phút | β- | – | 211Bi |
| 212Pb | Vết | 10,64 giờ | β- | – | 212Bi |
| 214Pb | Vết | 26,9 phút | β- | – | 214Bi |
Tính chất vật lý của chì
Nguyên tử
Một nguyên tử chì có 82 electron, với cấu hình electron [Xe]4f145d106s26p2. Năng lượng ion hóa thứ nhất và thứ hai kết hợp—tổng năng lượng cần thiết để loại bỏ hai electron 6p—tương tự như năng lượng ion hóa của thiếc, nguyên tử lân cận chì ở trên trong nhóm cacbon. Điều này khá bất thường, vì năng lượng ion hóa thường giảm dần theo nhóm do các electron ngoài cùng ở xa hạt nhân hơn và được che chắn nhiều hơn bởi các orbital bên trong.
Nguyên khối
Chì nguyên chất có màu xám sáng bóng với ánh xanh lam nhạt. Chì bị xỉn màu khi tiếp xúc với không khí ẩm, tạo thành bề mặt xỉn màu, màu sắc phụ thuộc vào điều kiện môi trường. Chì có đặc điểm là mật độ cao, dễ uốn, dễ kéo dài và khả năng chống ăn mòn do thụ động hóa.
Cấu trúc lập phương tâm diện xếp khít và khối lượng nguyên tử cao khiến chì có khối lượng riêng 11,34 g/cm3, lớn hơn khối lượng riêng của các kim loại thông thường như sắt (7,87 g/cm3), đồng (8,93 g/cm3) và kẽm (7,14 g/cm3).
Đồng vị
Chì tự nhiên bao gồm bốn đồng vị bền với số khối 204, 206, 207 và 208, cùng với dấu vết của sáu đồng vị phóng xạ có chu kỳ sống ngắn với số khối 209–214. Số lượng đồng vị tương đối cao phù hợp với số nguyên tử chẵn của chì. Chì có số proton ma thuật (82), khiến hạt nhân của nó đặc biệt bền theo mô hình vỏ hạt nhân.
Hóa học
Khi tiếp xúc với không khí ẩm, chì dạng khối tạo thành một lớp bề mặt bảo vệ có thành phần thay đổi. Chì(II) cacbonat là một thành phần phổ biến, và trong môi trường đô thị hoặc ven biển, chì(II) sunfat hoặc chì(II) clorua cũng có thể có mặt.
Lớp này làm cho chì khối trở nên trơ về mặt hóa học trong điều kiện khí quyển. Ngược lại, chì dạng bột mịn, giống như nhiều kim loại khác, dễ cháy và cháy với ngọn lửa màu trắng xanh.
Hợp chất vô cơ
Chì thể hiện hai trạng thái oxy hóa chính: +4 và +2. Trong khi trạng thái hóa trị bốn là đặc trưng của nhóm cacbon, trạng thái hóa trị hai lại hiếm gặp ở cacbon và silic, ít phổ biến hơn ở germani, đáng kể nhưng không chiếm ưu thế ở thiếc, và phổ biến nhất ở chì.
Chì (II)
Các hợp chất Chì(II) là đặc trưng của hóa học vô cơ của chì. Ngay cả các tác nhân oxy hóa mạnh như flo và clo cũng phản ứng với chì chỉ tạo ra PbF2 và PbCl2. Các ion Chì(II) thường không màu trong dung dịch, và thủy phân một phần tạo thành Pb(OH)+ và cuối cùng là [Pb4(OH)4]4+ (trong đó các ion hydroxyl đóng vai trò là phối tử bắc cầu), nhưng không phải là chất khử như ion thiếc(II).
Chì (IV)
Rất ít hợp chất Chì(IV) vô cơ được biết đến. Chúng chỉ được hình thành trong các dung dịch oxy hóa mạnh và thường không tồn tại trong điều kiện tiêu chuẩn. Chì (II) oxit tạo ra oxit hỗn hợp khi oxy hóa tiếp, Pb3O4. Nó được mô tả là chì (II, IV) oxit, hoặc về mặt cấu trúc là 2PbO·PbO2, và là hợp chất chì hóa trị hỗn hợp được biết đến nhiều nhất.
Nguồn gốc và sự xuất hiện
Trong không gian
Mật độ của chì trên mỗi hạt trong Hệ Mặt Trời là 0,121 ppb (phần tỷ). Con số này cao gấp hai lần rưỡi so với bạch kim, gấp tám lần so với thủy ngân và gấp mười bảy lần so với vàng.
Lượng chì trong vũ trụ đang tăng dần khi hầu hết các nguyên tử nặng hơn (tất cả đều không ổn định) dần phân rã thành chì. Sự phong phú của chì trong Hệ Mặt Trời kể từ khi hình thành cách đây 4,5 tỷ năm đã tăng khoảng 0,75%.
Trên Trái Đất
Chì được phân loại là đồng vị theo phân loại Goldschmidt, nghĩa là nó thường được tìm thấy kết hợp với lưu huỳnh. Nó hiếm khi tồn tại ở dạng kim loại tự nhiên.
Nhiều khoáng chất chì tương đối nhẹ và trong suốt lịch sử Trái Đất, chúng vẫn nằm trong lớp vỏ thay vì chìm sâu hơn vào bên trong. Điều này giải thích cho hàm lượng chì tương đối cao trong lớp vỏ Trái Đất là 14 ppm; đây là nguyên tố phổ biến thứ 36 trong lớp vỏ.
Từ nguyên
Từ lead trong tiếng Anh hiện đại có nguồn gốc từ tiếng Đức; nó bắt nguồn từ tiếng Anh trung đại leed và tiếng Anh cổ lēad (với dấu gạch ngang phía trên chữ “e” biểu thị rằng nguyên âm của chữ cái đó dài). Từ tiếng Anh cổ bắt nguồn từ từ *lauda- (‘chì’) trong tiếng Đức nguyên thủy được tái tạo theo giả thuyết. Theo lý thuyết ngôn ngữ học, từ này có nhiều hậu duệ trong nhiều ngôn ngữ Đức có cùng nghĩa.
Sản xuất chì
Tính đến năm 2014, sản lượng chì đang tăng trên toàn thế giới do được sử dụng trong ắc quy chì-axit. Có hai loại sản xuất chính: nguyên khai từ quặng khai thác và thứ cấp từ phế liệu.
Năm 2014, 4,58 triệu tấn đến từ sản xuất nguyên khai và 5,64 triệu tấn đến từ sản xuất thứ cấp. Ba nhà sản xuất chì cô đặc khai thác hàng đầu trong năm đó là Trung Quốc, Úc và Hoa Kỳ. Ba nhà sản xuất chì tinh chế hàng đầu là Trung Quốc, Hoa Kỳ và Ấn Độ.
Nguyên khai
Hầu hết quặng chì chứa hàm lượng chì thấp (quặng giàu có hàm lượng điển hình là 3–8%) và phải được cô đặc để khai thác. Trong quá trình xử lý ban đầu, quặng thường trải qua quá trình nghiền, tách môi trường đặc, nghiền, tuyển nổi bọt và sấy khô. Tinh quặng thu được, có hàm lượng chì từ 30–80% khối lượng (thường là 50–60%), sau đó được chuyển thành kim loại chì (không tinh khiết).
Quy trình trực tiếp
Trong quy trình này, chì thỏi và xỉ được thu được trực tiếp từ tinh quặng chì. Tinh quặng chì sunfua được nấu chảy trong lò và bị oxy hóa, tạo thành chì monoxit.
Cacbon (dưới dạng than cốc hoặc khí than [n]) được thêm vào hỗn hợp nóng chảy cùng với các chất trợ dung. Chì monoxit do đó được khử thành chì kim loại, nằm giữa xỉ giàu chì monoxit.
Ứng dụng của chì trong công nghiệp
Dạng nguyên tố
Chì kim loại có một số đặc tính cơ học hữu ích, bao gồm khối lượng riêng cao, điểm nóng chảy thấp, độ dẻo và độ trơ tương đối. Nhiều kim loại vượt trội hơn chì ở một số khía cạnh này nhưng nhìn chung ít phổ biến hơn và khó khai thác hơn từ quặng mẹ. Độc tính của chì đã dẫn đến việc loại bỏ dần một số ứng dụng.
Chì được sử dụng để phủ lên các thành lũy bảo vệ đường lên Lâu đài Alamut ở Ba Tư, nơi có thể hấp thụ các cuộc tấn công của máy công thành.
Pin
Ứng dụng chì lớn nhất vào đầu thế kỷ 21 là trong pin axit chì. Chì trong pin không tiếp xúc trực tiếp với con người, do đó ít có lo ngại về độc tính hơn. Những người làm việc trong các nhà máy sản xuất hoặc tái chế pin chì có thể tiếp xúc với bụi chì và hít phải bụi chì.
Lớp phủ cho cáp
Chì được sử dụng trong cáp điện cao thế làm vật liệu vỏ để ngăn nước thẩm thấu vào lớp cách điện; việc sử dụng này đang giảm dần do chì đang dần bị loại bỏ. Việc sử dụng chì trong hàn cho thiết bị điện tử cũng đang bị một số quốc gia loại bỏ để giảm lượng chất thải nguy hại cho môi trường.
Hợp chất
Ngoài việc là ứng dụng chính của kim loại chì, pin axit chì cũng là vật liệu tiêu thụ chính các hợp chất chì. Phản ứng lưu trữ/giải phóng năng lượng được sử dụng trong các thiết bị này bao gồm chì sunfat và chì dioxit.
Tác động sinh học của chì
Độc tính
Chì là một kim loại cực độc (dù hít phải hay nuốt phải), ảnh hưởng đến hầu hết mọi cơ quan và hệ thống trong cơ thể con người.[261] Ở nồng độ trong không khí là 100 mg/m3, chì gây nguy hiểm ngay lập tức đến tính mạng và sức khỏe. Hầu hết chì ăn vào sẽ được hấp thụ vào máu.
Tác động
Chì có thể gây tổn thương nghiêm trọng cho não và thận, và cuối cùng là tử vong. Bằng cách bắt chước canxi, chì có thể vượt qua hàng rào máu não. Chì làm thoái hóa bao myelin của tế bào thần kinh, làm giảm số lượng tế bào thần kinh, cản trở các đường dẫn truyền thần kinh và làm giảm sự phát triển của tế bào thần kinh.
Nguồn phơi nhiễm
Phơi nhiễm chì là một vấn đề toàn cầu do hoạt động khai thác và luyện kim chì, cũng như sản xuất, xử lý và tái chế pin diễn ra phổ biến ở nhiều quốc gia. Chì xâm nhập vào cơ thể qua đường hô hấp, tiêu hóa hoặc hấp thụ qua da. Hầu hết lượng chì hít vào đều được cơ thể hấp thụ; tỷ lệ hấp thụ qua đường tiêu hóa là 20–70%, trong đó trẻ em hấp thụ tỷ lệ cao hơn người lớn.
Chì trong thực phẩm
Chì có thể có trong thực phẩm khi thực phẩm được trồng trên đất có hàm lượng chì cao, chì trong không khí làm ô nhiễm cây trồng, động vật ăn chì trong chế độ ăn uống của chúng, hoặc chì xâm nhập vào thực phẩm từ nơi được bảo quản hoặc nấu chín. Ăn phải sơn và pin chì cũng là một con đường phơi nhiễm đối với gia súc, sau đó có thể ảnh hưởng đến con người.
Điều trị
Điều trị ngộ độc chì thường bao gồm việc sử dụng dimercaprol và succimer. Các trường hợp cấp tính có thể cần sử dụng dinatri canxi edetate, chelate canxi và muối dinatri của axit ethylenediaminetetraacetic (EDTA). EDTA có ái lực với chì mạnh hơn canxi, do đó chelate chì được hình thành do trao đổi và bài tiết qua nước tiểu, để lại canxi vô hại.