Nhôm là gì? Ảnh hưởng sinh học của nhôm
Nhôm là gì?
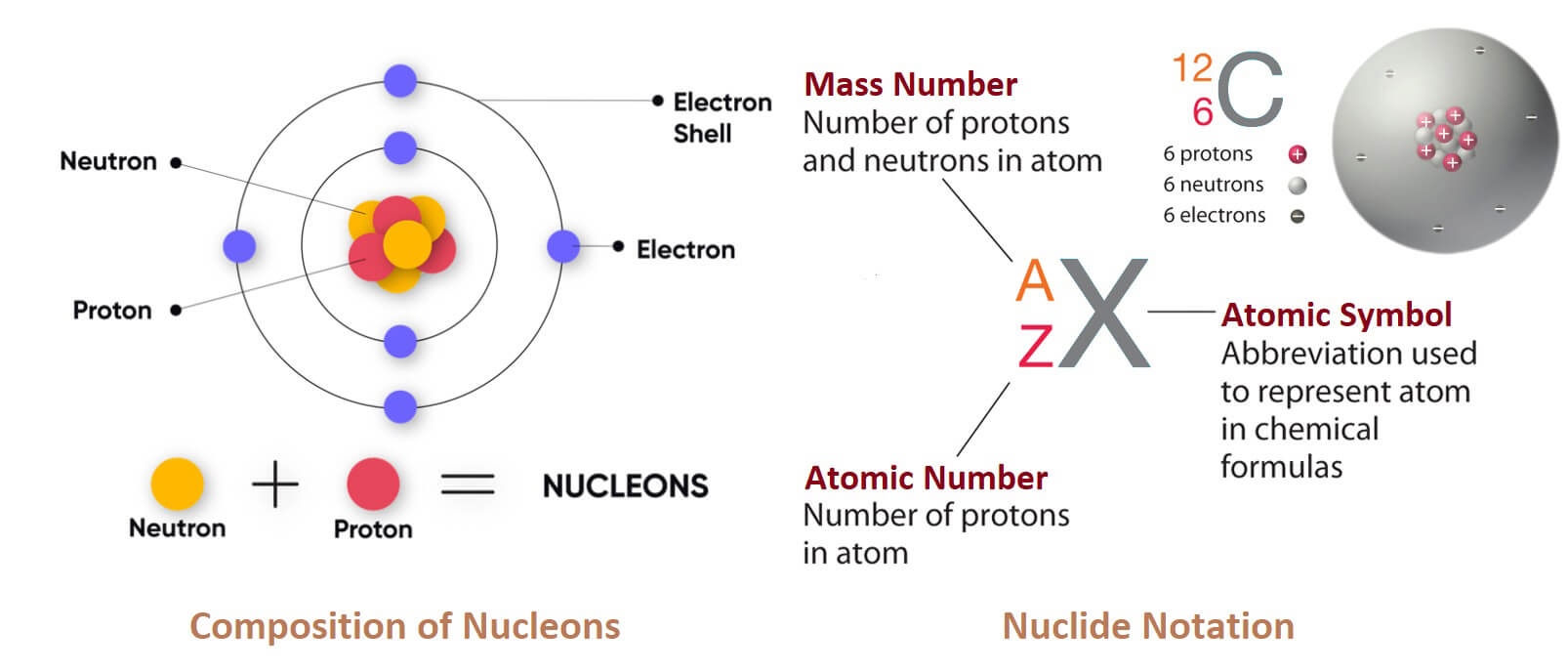
Nhôm hay Aluminium (tên gọi theo hệ thống IUPAC và được sử dụng trong các quốc gia thuộc Khối Thịnh vượng chung) hay aluminum (theo tiếng Anh Bắc Mỹ) là một nguyên tố hóa học, ký hiệu Al, có số hiệu nguyên tử 13.
Nhôm có khối lượng riêng thấp hơn nhiều kim loại thông dụng khác, chỉ bằng khoảng một phần ba khối lượng riêng của thép. Nhôm có độ ái lực rất cao với oxy, nên khi tiếp xúc với không khí, một lớp màng oxit mỏng và bền vững sẽ tự động hình thành trên bề mặt, đóng vai trò lớp bảo vệ chống ăn mòn.
Về đặc điểm vật lý, nhôm có vẻ ngoài tương tự bạc, với màu sáng và khả năng phản xạ ánh sáng rất tốt. Nó là kim loại mềm, phi từ tính và có tính dẻo cao, dễ dàng gia công tạo hình.
Nhôm có một đồng vị bền duy nhất là ²⁷Al, chiếm tỉ lệ rất cao trong tự nhiên, khiến nhôm trở thành nguyên tố phổ biến thứ 12 trong vũ trụ.
Do có tính phóng xạ, đồng vị ²⁶Al của nhôm được sử dụng trong phương pháp định tuổi phóng xạ (radiometric dating), giúp xác định niên đại của các vật chất tự nhiên như thiên thạch, trầm tích và mẫu địa chất cổ.
| Nhôm (Aluminium) | |
| Ngoại quan | Màu xám bạc, ánh kim loại |
| Nguyên tử khối Ar°(Al) | Ar(Al) = 26.981 5384 ± 0.000 0003 Phiên bản rút gọn: 26.982 ± 0.001 |
| Vị trí trong bảng tuần hoàn | Nằm giữa Magnesium (Mg) và Silicon (Si) trong chu kỳ 3 Nằm giữa Boron (B) và Gallium (Ga) trong nhóm 13 |
| Số hiệu nguyên tử (Z) | 13 |
| Nhóm | 13 |
| Chu kỳ | 3 |
| Khối | Khối p |
| Cấu hình electron | [Ne] 3s² 3p¹ |
| Số electron trên mỗi lớp | 2,8,3 |
| Tính chất vật lý | |
| Trạng thái ở điều kiện tiêu chuẩn | Rắn |
| Nhiệt độ nóng chảy | 933.47 K (660.32 °C; 1220.58 °F) |
| Nhiệt độ sôi | 2743 K (2470 °C; 4478 °F) |
| Khối lượng riêng ở 20 °C | 2.699 g/cm³ |
| Khối lượng riêng khi ở trạng thái lỏng tại điểm nóng chảy | 2.375 g/cm³ |
| Nhiệt nóng chảy | 10.71 kJ/mol |
| Nhiệt hóa hơi | 284 kJ/mol |
| Nhiệt dung molar | 24.20 J/(mol·K) |
| Tính chất nguyên tử | |
| Trạng thái oxi hóa | Số Oxi Hóa Phổ Biến: +3 Các Số Oxi Hóa Khác: −2, −1, 0, +1, +2 |
| Độ âm điện | Thang Pauling: 1.61 |
| Năng lượng ion hóa | Lần 1: 577.5 kJ/mol Lần 2: 1816.7 kJ/mol Lần 3: 2744.8 kJ/mol |
| Bán kính nguyên tử | Thực nghiệm: 143 pm |
| Bán kính cộng hoá trị | 121 ± 4 pm |
| Bán kính Van der Waals | 184 pm |
| Áp suất hơi | ||||||
| Áp suất P (Pa) | 1 | 10 | 100 | 1 k | 10 k | 100 k |
| Nhiệt độ T (K) | 1482 | 1632 | 1817 | 2054 | 2364 | 2790 |
| Các tính chất khác | |
| Nguồn gốc tự nhiên | Nguyên thủy |
| Cấu trúc tinh thể | Lập phương tâm diện – face-centered cubic (fcc) (ký hiệu cF4) |
| Hằng số mạng tinh thể | a = 404.93 pm (ở 20 °C) |
| Hệ số giãn nở nhiệt | 22.87 × 10⁻⁶ /K (ở 20 °C) |
| Độ dẫn nhiệt | 237 W/(m·K) |
| Điện trở suất | 26.5 nΩ·m (ở 20 °C) |
| Trật tự từ | Thuận từ |
| Độ cảm từ mol | +16.5 × 10⁻⁶ cm³/mol |
| Mô đun đàn hồi | 70 GPa |
| Mô đun trượt | 26 GPa |
| Mô đun nén | 76 GPa |
| Tốc độ truyền âm | 5000 m/s (ở nhiệt độ phòng, hình dạng: thanh cán mỏng) |
| Tỉ số Poisson | 0.35 |
| Độ cứng Mohs | 2.75 |
| Độ cứng Vickers | 160 – 350 MPa |
| Độ cứng Brinell | 160 – 550 MPa |
| Số CAS | 7429-90-5 |
| Lịch sử | |
| Nguồn gốc tên gọi | Xuất phát từ từ “alumine”, tên cũ của “alumina” (Al₂O₃) |
| Dự đoán sự tồn tại | Antoine Lavoisier (1782) |
| Phát hiện | Hans Christian Ørsted (1824) |
| Đặt tên bởi | Humphry Davy (1812) |
| Các đồng vị của nhôm | ||||
| Đồng vị chính | Phân rã | |||
| Tỷ lệ | Chu kỳ bán rã | Kiểu phân rã | Sản phẩm sau phân rã | |
| ²⁶Al | Vết đồng vị phóng xạ | 7.17 × 10⁵ năm | β⁺ (phát positron) | ²⁶Mg (magnesi-26) |
| ²⁷Al | 100% | Ổn định | ||
Tính chất vật lý của nhôm
Đồng vị
Nhôm có một đồng vị bền duy nhất là ²⁷Al, chiếm gần như toàn bộ lượng nhôm có trong tự nhiên. Điều này là phổ biến đối với các nguyên tố có số hiệu nguyên tử lẻ.
Do đó, nhôm là nguyên tố đơn đồng vị (mononuclidic) khi xác định khối lượng nguyên tử tiêu chuẩn và giá trị này hoàn toàn được quyết định bởi đồng vị đó. Nhôm có ích trong cộng hưởng từ hạt nhân (NMR) vì đồng vị bền duy nhất của nó (mặc dù có mômen tứ cực) có độ nhạy NMR cao.
Lớp vỏ electron
Một nguyên tử nhôm có 13 electron, với cấu hình electron là [Ne] 3s² 3p¹, tức là có ba electron ngoài cùng vượt ra ngoài cấu hình bền của khí hiếm. Vì vậy, tổng năng lượng ion hóa của ba electron đầu tiên của nhôm thấp hơn nhiều so với năng lượng ion hóa thứ tư. Cấu hình electron này giống với các nguyên tố khác cùng nhóm có đặc tính đã được nghiên cứu rõ, gồm bo (B), gali (Ga), indi (In) và thal (Tl) và cũng được dự đoán cho nihoni (Nh). Nhôm có thể nhường ba electron ngoài cùng trong nhiều phản ứng hóa học. Độ âm điện của nhôm là 1,61 theo thang Pauling.
Dạng khối
Kim loại nhôm có màu từ trắng bạc đến xám mờ, tùy thuộc vào độ nhẵn bề mặt của nó. Gương nhôm có độ phản xạ cao đối với ánh sáng trong vùng tử ngoại, khả kiến (tương đương bạc) và hồng ngoại xa. Nhôm cũng phản xạ tốt bức xạ Mặt Trời, tuy nhiên khi tiếp xúc lâu với ánh sáng mặt trời trong không khí, độ phản xạ của kim loại có thể giảm; điều này có thể được ngăn ngừa bằng quá trình anot hóa (anodizing), tạo một lớp oxit bảo vệ trên bề mặt.
Tính chất hóa học
Nhôm kết hợp đặc điểm của cả kim loại trước chuyển tiếp và sau chuyển tiếp. Vì có ít electron tham gia liên kết kim loại, giống như các nguyên tố nặng hơn trong nhóm 13, nhôm có tính chất vật lý của kim loại sau chuyển tiếp, với khoảng cách giữa các nguyên tử dài hơn dự kiến. Ngoài ra, vì ion Al³⁺ là một cation nhỏ và mang điện tích cao, nó có độ phân cực mạnh, khiến liên kết trong các hợp chất nhôm có xu hướng mang tính cộng hóa trị; hành vi này tương tự như berili (Be²⁺), thể hiện mối quan hệ chéo (diagonal relationship).
Hợp chất vô cơ
Phần lớn các hợp chất của nhôm, bao gồm mọi khoáng vật chứa nhôm và tất cả các hợp chất nhôm có giá trị thương mại, đều có nhôm ở trạng thái oxi hóa +3. Số phối trí của các hợp chất này khác nhau, nhưng thông thường Al³⁺ có phối trí bốn hoặc sáu. Hầu như tất cả các hợp chất nhôm(III) đều không màu.
Hợp chất hữu cơ nhôm và các hydride liên quan
Tồn tại nhiều loại hợp chất có công thức thực nghiệm AlR₃ và AlR₁.₅Cl₁.₅. Các nhôm trialkyl và triaryl là chất lỏng không màu, dễ bay hơi, hoạt tính cao hoặc rắn có điểm nóng chảy thấp. Chúng tự bốc cháy trong không khí và phản ứng với nước, do đó phải cẩn trọng khi thao tác. Chúng thường tạo thành dimer, không giống các chất tương tự của Bo, nhưng xu hướng này giảm đối với các nhóm ankyl mạch nhánh (ví dụ Me₃CCH₂).
Ứng dụng của nhôm
Kim loại Nhôm
Sản lượng nhôm toàn cầu năm 2016 đạt 58,8 triệu tấn, cao hơn bất kỳ kim loại nào khác ngoại trừ sắt (1.231 triệu tấn).
Nhôm hầu như luôn được tạo hợp kim, giúp cải thiện đáng kể tính cơ học, đặc biệt là sau khi tôi luyện (tempered). Ví dụ, giấy bạc nhôm và lon đồ uống thông thường là hợp kim chứa 92%–99% nhôm.
Các nguyên tố hợp kim chính của nhôm rèn và nhôm đúc là đồng, kẽm, magiê, mangan và silic (ví dụ duralumin), với tỷ lệ các kim loại khác chỉ chiếm vài phần trăm khối lượng.
Các ứng dụng chính của nhôm bao gồm:
- Giao thông vận tải (ô tô, máy bay, xe tải, toa tàu, tàu biển, xe đạp, tàu vũ trụ,…). Nhôm được sử dụng vì khối lượng riêng thấp, độ bền cao và khả năng chống ăn mòn.
- Bao bì (lon, giấy bạc, khung,…). Nhôm được dùng vì không độc, không hấp phụ và không bị vỡ vụn.
- Xây dựng và kiến trúc (cửa sổ, cửa ra vào, vách ngăn, tấm ốp, mái nhà,…). Vì thép rẻ hơn, nên nhôm được sử dụng khi yếu tố nhẹ, chống ăn mòn hoặc yêu cầu kỹ thuật đặc biệt là quan trọng.
- Ngành điện – điện tử (hợp kim dẫn điện, động cơ, máy phát điện, máy biến áp, tụ điện,…). Nhôm được sử dụng vì giá thành thấp, dẫn điện tốt, độ bền cơ học đủ dùng, khối lượng riêng nhỏ và chống ăn mòn tốt.
- Ứng dụng trong nhiều loại đồ gia dụng, từ dụng cụ nấu ăn đến đồ nội thất. Các yếu tố chính khiến nhôm được ưa chuộng là khối lượng riêng thấp, vẻ ngoài sáng đẹp, dễ gia công, và bền lâu. Nhôm là vật liệu được ưa chuộng để chế tạo nồi, chảo, đĩa và dụng cụ nấu ăn, vì dẫn nhiệt nhanh, nguội nhanh và có chi phí hợp lý. Do đó, nó được sử dụng cả trong các nhà hàng thức ăn nhanh lẫn trong bếp gia đình.
- Máy móc và thiết bị (thiết bị chế biến, đường ống, dụng cụ). Nhôm được sử dụng nhờ khả năng chống ăn mòn, không tự bốc cháy và độ bền cơ học tốt.
Các hợp chất của Nhôm
Nhiều hợp chất của nhôm có ứng dụng chuyên biệt, ví dụ:
- Nhôm axetat (Aluminium acetate) ở dạng dung dịch được sử dụng như một chất làm se (astringent)
- Nhôm photphat (Aluminium phosphate) được sử dụng trong sản xuất thủy tinh, gốm sứ, các sản phẩm bột giấy và giấy, mỹ phẩm, sơn, vec-ni, và trong xi măng nha khoa.
- Nhôm hydroxit (Aluminium hydroxide) được sử dụng làm thuốc kháng axit và chất gắn màu (mordant); nó cũng được sử dụng trong quá trình lọc nước, sản xuất thủy tinh và gốm sứ, và trong việc chống thấm vải.
- Lithi nhôm hiđrua (Lithium aluminium hydride) là một chất khử mạnh được sử dụng trong hóa học hữu cơ.
- Các hợp chất cơ-nhôm (Organoaluminiums) được sử dụng làm axit Lewis và đồng chất xúc tác (co-catalysts).
- Methylaluminoxan là một đồng chất xúc tác trong phản ứng trùng hợp olefin kiểu Ziegler–Natta, để tạo ra polymer vinyl như polyetylen.
- Các ion nhôm dạng dung dịch (như nhôm sulfat) được sử dụng để điều trị ký sinh trùng cá như Gyrodactylus salaris.
- Trong nhiều loại vắc-xin, một số muối nhôm đóng vai trò làm chất bổ trợ miễn dịch (immune adjuvant – chất tăng cường phản ứng miễn dịch) để cho phép protein trong vắc-xin đạt được hiệu lực (potency) cần thiết như một chất kích thích miễn dịch. Trước năm 2004, phần lớn các chất bổ trợ dùng trong vắc-xin đều có chứa nhôm.
Ảnh hưởng sinh học
Độc tính
Nhôm được Bộ Y tế và Dịch vụ Nhân sinh Hoa Kỳ phân loại là chất không gây ung thư.
Một báo cáo công bố năm 1988 cho biết hầu như không có bằng chứng cho thấy việc tiếp xúc thông thường với nhôm gây rủi ro cho người trưởng thành khỏe mạnh, và một tổng quan độc chất học đa nguyên tố năm 2014 cũng không tìm thấy tác động có hại khi lượng nhôm hấp thụ không vượt quá 40 mg/ngày trên mỗi Kg khối lượng cơ thể.
Phần lớn nhôm được tiêu thụ sẽ thải ra khỏi cơ thể qua phân và bất kỳ lượng nào đi vào máu sẽ được bài tiết qua nước tiểu.
Tác động của nhôm đối với sức khỏe
Dù hiếm gặp nhưng Nhôm có thể gây ra nhuyễn xương kháng vitamin D, thiếu máu hồng cầu nhỏ kháng erythropoietin và rối loạn hệ thần kinh trung ương. Đặc biệt, những người suy giảm chức năng thận có nguy cơ cao hơn. Việc sử dụng lâu dài silicat nhôm ngậm nước để kiểm soát tình trạng dư thừa axit dạ dày có thể khiến nhôm liên kết với các chất trong ruột và tăng thải các kim loại khác như sắt hoặc kẽm; liều lượng đủ cao (>50g/ngày) có thể gây thiếu máu.
Đường phơi nhiễm
Thực phẩm là nguồn phơi nhiễm nhôm chính. Nước uống chứa nhiều nhôm hơn thực phẩm rắn. Tuy nhiên, nhôm trong thực phẩm có thể được hấp thụ nhiều hơn nhôm trong nước.
Các nguồn phơi nhiễm nhôm qua đường tiêu hóa chủ yếu gồm: thực phẩm (do sử dụng trong phụ gia thực phẩm, bao bì thực phẩm và đồ uống, và dụng cụ nấu ăn), nước uống (do sử dụng trong xử lý nước thành phố), và thuốc có chứa nhôm (đặc biệt là các công thức thuốc kháng axit/chống loét và aspirin đệm).
Mức hấp thụ nhôm qua khẩu phần ăn ở người châu Âu trung bình khoảng 0,2–1,5 mg/kg/tuần, nhưng có thể lên tới 2,3 mg/kg/tuần. Những người có mức phơi nhiễm cao thường là thợ ống nước, thợ xây, công nhân điện, thợ cơ khí và bác sĩ phẫu thuật.
Điều trị
Trong trường hợp nghi ngờ hấp thụ đột ngột lượng lớn nhôm, phương pháp điều trị duy nhất là dùng Deferoxamine mesylate, có thể được tiêm để loại bỏ nhôm khỏi cơ thể thông qua liệu pháp liệu pháp thải sắt/thải độc kim loại (chelation therapy).
Tác động đến Môi trường
Nồng độ nhôm cao thường xuất hiện gần các khu vực khai thác mỏ, trong khi một lượng nhỏ nhôm cũng được phát thải vào môi trường từ nhà máy nhiệt điện than hoặc lò đốt rác thải.
Mưa axit là yếu tố tự nhiên chính khiến nhôm được giải phóng khỏi các nguồn tự nhiên, đồng thời là nguyên nhân chủ yếu gây ra các tác động môi trường của nhôm. Tuy nhiên, nguyên nhân chính khiến nhôm xuất hiện trong nước ngọt và nước mặn là các quá trình công nghiệp thải nhôm vào không khí.
Trong môi trường nước có tính axit, nhôm hoạt động như một chất độc đối với động vật hô hấp bằng mang như cá, nhôm có thể kết tủa trên mang, gây mất ion trong huyết tương và dịch tuần hoàn, dẫn đến rối loạn điều hòa thẩm thấu.
Các phức hợp hữu cơ của nhôm có thể dễ dàng được hấp thụ và gây ảnh hưởng đến quá trình trao đổi chất ở động vật có vú và chim, mặc dù điều này hiếm khi xảy ra trong thực tế.
Nhôm là một trong những yếu tố chính làm giảm sự phát triển của thực vật. Mặc dù nhôm không gây hại cho cây trồng trong đất trung tính (pH ≈ 7), nhưng trong đất có tính axit, nồng độ ion Al³⁺ độc hại tăng cao, làm rối loạn sự phát triển và chức năng của rễ cây.
Quá trình sản xuất nhôm tạo ra những thách thức riêng đối với môi trường ở mọi giai đoạn của chu trình sản xuất.