Sắt là gì? Tại sao Iron khác biệt
Sắt là gì?
Sắt (Iron) là một nguyên tố hóa học, ký hiệu Fe (từ tiếng Latinh ferrum – nghĩa là “sắt”), có số hiệu nguyên tử là 26. Đây là kim loại thuộc dãy chuyển tiếp đầu tiên và nhóm 8 trong bảng tuần hoàn.
Tính theo khối lượng, sắt là nguyên tố phổ biến nhất trên Trái Đất, chiếm phần lớn thành phần của lõi ngoài và lõi trong Trái Đất, đồng thời là nguyên tố phong phú thứ tư trong lớp vỏ Trái Đất. Ở trạng thái kim loại tự nhiên, sắt chủ yếu có nguồn gốc từ các thiên thạch rơi xuống Trái Đất.
| Sắt (Iron – Fe) | |
| Phát âm: | /ˈaɪərn/ |
| Thù hình: | xem mục Allotropes of iron |
| Hình dạng: | kim loại sáng bóng có ánh xám |
| Khối lượng nguyên tử chuẩn (Ar°(Fe)) | 55.845 ± 0.002 |
| Sắt trong bản tuần hoàn | |
| Số hiệu nguyên tử (Z) | 26 |
| Nhóm | Nhóm 8 |
| Chu kỳ | Chu kỳ 4 |
| Khối | Khối d (d-block) |
| Cấu hình electron | [Ar] 3d⁶ 4s² |
| Số electron theo lớp | 2, 8, 14, 2 |
| Tính chất vật lý | |
| Trạng thái ở điều kiện tiêu chuẩn (STP) | Rắn |
| Điểm nóng chảy | 1811 K (1538 °C, 2800 °F) |
| Điểm sôi | 3134 K (2861 °C, 5182 °F) |
| Khối lượng riêng (ở 20 °C) | 7.874 g/cm³ |
| Khi ở trạng thái lỏng (ở điểm nóng chảy) | 6.98 g/cm³ |
| Nhiệt nóng chảy | 13.81 kJ/mol |
| Nhiệt hóa hơi | 340 kJ/mol |
| Nhiệt dung mol | 25.10 J/(mol·K) |
| Áp suất hơi | ||||||
| P (Pa) | 1 | 10 | 100 | 1k | 10k | 100k |
| T (K) | 1728 | 1890 | 2091 | 2346 | 2679 | 3132 |
| Tính chất nguyên tử | |
| Trạng thái oxy hóa | Thông thường: +2, +3; có thể: -2, -1, 0, +1, +4, +5, +6, +7 |
| Độ âm điện (thang Pauling) | 1.83 |
| Năng lượng ion hóa | Lần 1: 762.5 kJ/mol • Lần 2: 1561.9 kJ/mol • Lần 3: 2957 kJ/mol |
| Bán kính nguyên tử (thực nghiệm) | 126 pm |
| Bán kính cộng hóa trị | Spin thấp: 132 ± 3 pm • Spin cao: 152 ± 6 pm |
| Bán kính Van der Waals | 194 pm |
| Các tính chất khác | |
| Nguồn gốc tự nhiên | Nguyên sinh (primordial) |
| Cấu trúc tinh thể α-Fe | Lập phương tâm khối (bcc – body-centered cubic) |
| Hằng số mạng tinh thể (α-Fe) | a = 286.65 pm (ở ≤ 912 °C) |
| Cấu trúc tinh thể γ-Fe | Lập phương tâm mặt (fcc – face-centered cubic) |
| Hằng số mạng tinh thể (γ-Fe) | a = 364.68 pm (ở 916 °C) |
| Giãn nở nhiệt (ở 20 °C) | 12.07 × 10⁻⁶ /K |
| Độ dẫn nhiệt | 80.4 W/(m·K) |
| Điện trở suất (ở 20 °C) | 96.1 nΩ·m |
| Điểm Curie | 1043 K |
| Tính từ | Sắt từ (ferromagnetic) |
| Mô đun Young | 211 GPa |
| Mô đun trượt (Shear modulus) | 82 GPa |
| Mô đun nén (Bulk modulus) | 170 GPa |
| Vận tốc truyền âm (thanh mảnh) | 5120 m/s |
| Hệ số Poisson | 0.29 |
| Độ cứng Mohs | 4 |
| Độ cứng Vickers | 608 MPa |
| Độ cứng Brinell | 200–1180 MPa |
| Số CAS | 7439-89-6 |
| Lịch sử | |
| Tên gọi | Có nguồn gốc từ gốc PIE nghĩa là “máu”, ám chỉ màu đỏ của các oxit sắt |
| Phát hiện | Trước năm 5000 TCN |
| Ký hiệu hóa học | Fe (từ tiếng Latinh Ferrum) |
| Đơn vị của Sắt | ||||
| Đồng vị | Độ phổ biến | Chu kỳ bán rã (t₁/₂) | Dạng phân rã | Sản phẩm |
| ⁵⁴Fe | 5.85 % | Ổn định | ||
| ⁵⁵Fe | Tổng hợp | 2.7562 γ | ε | ⁵⁵Mn |
| ⁵⁶Fe | 91.8 % | Ổn định | ||
| ⁵⁷Fe | 2.12 % | Ổn định | ||
| ⁵⁸Fe | 0.28 % | Ổn định | ||
| ⁵⁹Fe | Tổng hợp | 44.50 d | β⁻ | ⁵⁹Co |
| ⁶⁰Fe | Rất hiếm | 2.62 × 10⁶ γ | β⁻ | ⁶⁰Co |
Đặc điểm của sắt
Các dạng thù hình
Sắt tồn tại ở ít nhất bốn dạng thù hình khác nhau (tức là các cách sắp xếp nguyên tử khác nhau trong tinh thể rắn), được ký hiệu là α, γ, δ, và ε.
Ba dạng đầu tiên được quan sát thấy ở điều kiện áp suất thường. Khi sắt nóng chảy nguội xuống dưới 1538°C, nó kết tinh thành dạng δ-sắt với cấu trúc tinh thể lập phương tâm khối (bcc). Khi nguội đến 1394°C, nó chuyển sang γ-sắt, có cấu trúc lập phương tâm mặt (fcc), còn gọi là austenit. Khi tiếp tục hạ nhiệt xuống 912°C, cấu trúc lại trở thành bcc α-sắt, là dạng phổ biến ở nhiệt độ phòng.
Điểm nóng chảy và điểm sôi
Điểm nóng chảy, điểm sôi và năng lượng nguyên tử hóa của sắt thấp hơn so với các nguyên tố 3d trước đó (từ scandium đến chromium), do các electron 3d ngày càng bị hút chặt vào lõi nguyên tử, làm giảm khả năng tham gia liên kết kim loại.
Điểm nóng chảy của sắt được xác định rõ ở áp suất dưới 50 GPa; ở áp suất cao hơn, các dữ liệu công bố (tính đến năm 2007) vẫn còn khác nhau hàng chục gigapascal và hơn một nghìn kelvin.
Tính từ
Dưới điểm Curie 770°C (1040 K), α-sắt chuyển từ trạng thái thuận từ (paramagnetic) sang sắt từ (ferromagnetic) – tức là các spin của hai electron chưa ghép cặp trong mỗi nguyên tử sắt có xu hướng song song với spin của các nguyên tử lân cận, tạo nên từ trường tổng thể.
Điều này xảy ra vì hai electron (ở orbital dz² và dx²−y²) không định hướng về phía các nguyên tử kế bên trong mạng tinh thể, nên chúng không tham gia vào liên kết kim loại.
Nguồn gốc và sự tồn tại của sắt trong tự nhiên
Nguồn gốc vũ trụ
Sự phong phú của sắt trong các hành tinh đá như Trái Đất là do nó được tạo ra hàng loạt trong quá trình nổ siêu tân tinh loại Ia, khi các phản ứng hợp hạch dây chuyền xảy ra và phân tán sắt ra không gian vũ trụ.
Sắt kim loại tự nhiên
Sắt kim loại (dạng nguyên chất) rất hiếm khi tồn tại trên bề mặt Trái Đất vì dễ bị oxy hóa. Tuy nhiên, lõi ngoài và lõi trong của Trái Đất, chiếm khoảng 35% khối lượng toàn cầu, được cho là hợp kim sắt – niken.
Các dòng điện trong lõi ngoài lỏng của Trái Đất được tin là nguồn gốc của từ trường Trái Đất. Các hành tinh đất đá khác như Sao Thủy, Sao Kim, Sao Hỏa và Mặt Trăng cũng được cho là có lõi kim loại chứa chủ yếu sắt. Các tiểu hành tinh loại M (M-type) cũng được cho là chứa nhiều hợp kim sắt kim loại.
Khoáng vật trong lớp phủ
Khoáng vật Ferro Periclase (Mg,Fe)O, là dung dịch rắn của periclase (MgO) và wüstite (FeO), chiếm khoảng 20% thể tích lớp phủ dưới của Trái Đất, là khoáng vật phổ biến thứ hai sau silicat perovskite [(Mg,Fe)SiO₃].
Trong lớp vỏ Trái Đất
Mặc dù sắt là nguyên tố phong phú nhất trong Trái Đất, nhưng phần lớn tập trung ở lõi. Lượng sắt trong lớp vỏ chỉ chiếm khoảng 5% khối lượng lớp vỏ, xếp thứ tư sau oxy, silic và nhôm.
Trong đại dương
Các nghiên cứu hải dương học cho thấy sắt đóng vai trò quan trọng trong sinh học biển cổ đại cũng như chu trình khí hậu Trái Đất thời tiền sử.
Hóa học và hợp chất của sắt
Sắt thể hiện đầy đủ các đặc trưng hóa học của kim loại chuyển tiếp, bao gồm khả năng tạo nhiều trạng thái oxy hóa khác nhau và có hóa học phối trí và hữu cơ – kim loại (organometallic) rất phong phú.
Sự khám phá ra hợp chất ferrocene trong thập niên 1950 đã mở ra một lĩnh vực mới trong hóa học kim loại hữu cơ.
| Trạng thái oxy hóa | Hợp chất đại diện |
| –2 (d¹⁰) | Natri tetracarbonylferrat (Disodium tetracarbonylferrate – thuốc thử Collman) |
| –1 (d⁹) | Fe₂(CO)₈²⁻ |
| 0 (d⁸) | Sắt pentacarbonyl (Iron pentacarbonyl) |
| +1 (d⁷) | Dimer sắt dicyclopentadienyl dicarbonyl (“Fp₂”) |
| +2 (d⁶) | Sắt(II) sunfat (Ferrous sulfate), Ferrocene |
| +3 (d⁵) | Sắt(III) clorua (Ferric chloride), Ferrocenium tetrafluoroborat |
| +4 (d⁴) | Fe(diars)₂Cl₂²⁺, FeO(BF₄)₂ |
| +5 (d³) | FeO₄³⁻ |
| +6 (d²) | Kali ferrat (Potassium ferrate) |
| +7 (d¹) | [FeO₄]⁻ (tồn tại ở điều kiện cách ly ma trận, 4K) |
Hợp chất nhị nguyên của sắt
Oxide và Sulfide
Sắt tạo nhiều oxide và hydroxide, phổ biến nhất là Fe₃O₄ (iron II,III oxide) và Fe₂O₃ (iron III oxide). FeO (iron II oxide) cũng tồn tại nhưng không bền ở nhiệt độ phòng. Các hợp chất này thực chất không có tỷ lệ hóa trị cố định.
Halide
Các halide hóa trị II và III của sắt đều rất quen thuộc. Các muối halide sắt(II) thường được điều chế bằng cách cho kim loại sắt phản ứng với axit halogen tương ứng, tạo ra muối hydrat của sắt(II).
Hợp chất hữu cơ – kim loại
Hóa học organo-sắt nghiên cứu các hợp chất mà nguyên tử sắt liên kết cộng hóa trị với nguyên tử carbon. Các hợp chất phổ biến gồm phức cyanide, carbonyl và các phức hỗn hợp khác.
Một ví dụ nổi tiếng là Xanh Phổ – Fe₄[Fe(CN)₆]₃, một phức sắt-cyanide lâu đời, được sử dụng làm chất màu và trong nhiều ứng dụng khác.
Phản ứng tạo ra Prussian blue cũng được dùng trong phép thử hóa ướt để phân biệt ion Fe²⁺ và Fe³⁺, thông qua phản ứng với kali ferricyanide và kali ferrocyanide.
Ứng dụng của sắt
- Dùng để sản xuất thép, cũng như trong xây dựng dân dụng (bê tông cốt thép, dầm, cột…).
- Dùng để chế tạo thép hợp kim như thép cacbon, thép niken, thép crom, vanadi, tungsten, mangan…
- Ứng dụng trong cầu, cột điện, xích xe đạp, dao cắt, nòng súng.
- Gang chứa 3–5% cacbon, được dùng để chế tạo ống, van, bơm.
- Chất xúc tác sắt được sử dụng trong quy trình Haber để sản xuất amoniac.
- Nam châm được chế tạo từ sắt và các hợp kim hoặc hợp chất của nó.
Tính chất vật lý của sắt
- Bị gỉ trong không khí ẩm, nhưng không gỉ trong môi trường khô.
- Tan trong axit loãng.
- Ở nhiệt độ phòng, tồn tại ở dạng α-sắt (ferrite).
- Ở 910°C, chuyển sang γ-sắt (austenite) – mềm hơn.
- Nóng chảy ở 1536°C, sôi ở 2861°C.
- Là kim loại có tính từ mạnh.
Vai trò sinh học và bệnh lý học
Hóa sinh học
Việc hấp thụ sắt là một vấn đề đối với các sinh vật hiếu khí vì sắt ở dạng ferric (Fe³⁺) có độ hòa tan rất thấp ở môi trường có pH trung tính.
Dinh dưỡng
Sắt có mặt khắp nơi, nhưng những nguồn thực phẩm giàu sắt đặc biệt bao gồm thịt đỏ, hàu, các loại đậu, thịt gia cầm, cá, rau lá xanh, cải xoong, đậu hũ và mật mía đen. Bánh mì và ngũ cốc ăn sáng đôi khi được bổ sung sắt một cách đặc biệt.
Khuyến nghị về chế độ ăn uống
Viện Y học Hoa Kỳ (U.S. Institute of Medicine – IOM) đã cập nhật Nhu cầu Trung bình Ước tính (EARs) và Lượng khuyến nghị hàng ngày (RDAs) cho sắt vào năm 2001:
- EAR hiện tại đối với phụ nữ từ 14–18 tuổi là 7,9 mg/ngày, từ 19–50 tuổi là 8,1 mg/ngày, và 5,0 mg/ngày sau thời kỳ mãn kinh.
- Đối với nam giới từ 19 tuổi trở lên, EAR là 6,0 mg/ngày.
- RDA là 15,0 mg/ngày cho phụ nữ từ 15–18 tuổi, 18,0 mg/ngày cho phụ nữ từ 19–50 tuổi, và 8,0 mg/ngày sau thời kỳ mãn kinh.
- Đối với nam giới từ 19 tuổi trở lên, RDA là 8,0 mg/ngày.
Thiếu sắt
Thiếu sắt là tình trạng thiếu dinh dưỡng phổ biến nhất trên thế giới. Khi lượng sắt bị mất không được bù đắp bằng chế độ ăn đầy đủ sắt, cơ thể sẽ rơi vào trạng thái thiếu sắt tiềm ẩn, và nếu kéo dài, sẽ dẫn đến thiếu máu do thiếu sắt – đặc trưng bởi số lượng hồng cầu thấp và hàm lượng hemoglobin không đủ.
Rối loạn tăng động giảm chú ý (ADHD)
Một số nghiên cứu cho thấy mức sắt thấp ở vùng đồi thị (thalamus) có thể đóng vai trò trong cơ chế bệnh sinh của ADHD. Một số nhà nghiên cứu nhận thấy bổ sung sắt có thể mang lại hiệu quả, đặc biệt đối với thể thiếu chú ý của rối loạn này.
Ung thư
Vai trò của sắt trong phòng chống ung thư có thể được ví như “con dao hai lưỡi”, do nó tham gia vào nhiều quá trình sinh lý bình thường.
Những người đang hóa trị liệu có thể bị thiếu sắt và thiếu máu, khi đó liệu pháp truyền sắt tĩnh mạch được sử dụng để phục hồi mức sắt.
Thừa sắt, có thể xảy ra do tiêu thụ quá nhiều thịt đỏ, có thể kích thích sự phát triển khối u và tăng nguy cơ khởi phát ung thư, đặc biệt là ung thư đại trực tràng.
Hệ sinh thái biển
Sắt đóng vai trò thiết yếu trong các hệ thống biển và có thể là yếu tố hạn chế đối với hoạt động của sinh vật phù du.
Tại sao sắt khác với các nguyên tố khác?
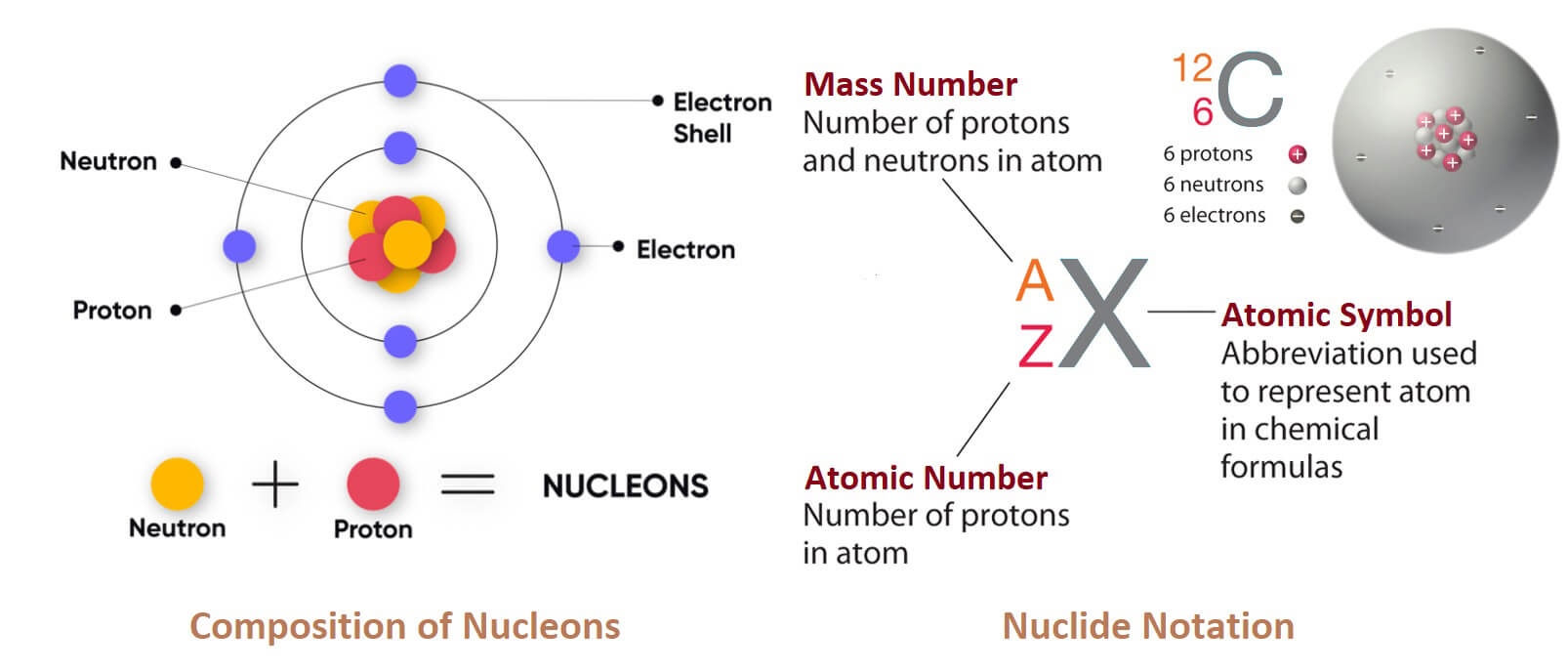
Sự khác biệt nằm ở số proton có trong hạt nhân nguyên tử. Số proton làm cho mỗi nguyên tố trở nên độc đáo, vì vậy chúng được sắp xếp theo những con số này trên bảng tuần hoàn. Số proton có trong một nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử.
Trong bảng tuần hoàn, con số này nằm phía trên ký hiệu nguyên tố. Sắt có 26 proton, vì vậy số hiệu nguyên tử của nó là 26. Việc sắt có 26 proton trong hạt nhân chính là yếu tố tạo nên sắt. Nếu thêm một proton vào hạt nhân của một nguyên tố sắt, tạo ra 27 proton, thì nó sẽ là một nguyên tố hoàn toàn khác. Thêm một proton nữa sẽ tạo ra nguyên tử của nguyên tố coban.
Lấy đi một proton của sắt sẽ tạo ra manmangan (Mn), có 25 proton trong hạt nhân. Việc thay đổi số proton sẽ tạo ra một nguyên tố hoàn toàn khác.